独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)健康工学研究部門【研究部門長 吉田 康一】先端融合テーマ探索グループ【研究グループ長 茂里 康】村瀬 至生 主任研究員、安藤 昌儀 主任研究員らは、複数のCdSe/ZnSコアシェル型量子ドット(半導体ナノ粒子)を蛍光特性を保ったまま微小なガラスカプセル(粒径20-100 nm)に封じ込めたガラスカプセル蛍光体を開発した。蛍光の輝度が高く、またガラスの耐久性が活かされているので、バイオ分野で基礎研究から臨床応用までの広い領域で蛍光試薬として使用できる。また、高輝度・高耐久性という特長を活かして、電子材料用の蛍光体としての用途も期待される。
細胞などを染色してその形態・分布・動きを観察するための蛍光試薬として、有機ポリマーで被覆した量子ドットが研究用として市販されている。しかし、量子ドットが1個ずつポリマーコートされているため輝度を高めることはできない。また、ポリマーは化学的に弱いので、バイオ用途に用いる場合には、量子ドット成分の溶出や劣化が生じやすい。このため、応用の範囲が限られていた。量子ドットをポリマーより安定なガラスに封じ込めるほうが有利であることから世界中で研究されてきたが、今まで実現できなかった。
今回、ゾル-ゲル法を用いた3段階合成法を開発し、蛍光性の量子ドットの中でも発光効率が高くて、スペクトル幅の狭いCdSe/ZnSコアシェル型量子ドットを、その特性を保ったまま高濃度でガラスカプセルの中に封じ込めた。その結果、高輝度・高耐光性でカドミウムの溶出量が少ない蛍光試薬が得られた。
 |
|
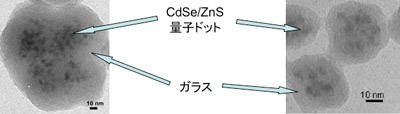
写真 開発した多数の量子ドットを分散した高輝度発光ガラスカプセル蛍光体の透過電子顕微鏡像。
カプセルのサイズは反応条件により制御できる。(左:粒径95 nm、右:粒径40 nm)
|
バイオ分野では、細胞や生体関連物質に結合させて、体内や体外でその形態、量、分布、動きを調べるために、蛍光試薬を用いている。従来は有機蛍光試薬が用いられているが、直径が2-10 nm程度の量子ドットは、高効率で発光し、耐光性が格段に高いので、高性能蛍光試薬として期待されている。この量子ドットは、吸収と発光の波長域が離れているので発光検出が容易である。また粒径を変えて、発光波長を調整することができる。
ところが、量子ドットは比表面積が大きいため凝集・沈殿しやすい。これを防ぐため、透明な材料で被覆して安定化し、溶媒への分散性を向上させる技術が開発されてきた。これまでに、ポリマーで被覆した量子ドットが市販されているが、発光輝度をさらに高めることは難しい。またバイオ用途では、高濃度の塩などを含む溶液中に希釈分散し、励起光として強い紫外線を照射するが、このような厳しい条件では、成分の溶出や紫外線による劣化のため発光輝度が低下したり、溶出したカドミウムなどの有毒成分により細胞死が起きたりするといった問題があった。そのため、細胞が食作用で取り込みやすい粒径100 nm以下の高輝度高耐久性量子ドット蛍光体が求められている。
ポリマーよりも丈夫なガラス中に量子ドットを高濃度に分散させて、高輝度発光と高耐久性(化学的耐久性および耐光性)を両立させる研究がこの10年程度の間、盛んに行われてきた。例えば、粒径数100 nmのシリカ微小球の表層付近に量子ドット分散ガラス層を付けた物や、1個の量子ドットを含むガラスカプセルが報告された。しかし、どちらも量子ドット分散濃度が低いので高輝度化は難しく、また後者では、発光効率を保つために、量子ドットに特別に厚いシェルを付ける必要があって作製に手間がかかり、いずれも蛍光試薬として用いるには十分な性能がえられていなかった。
一般に量子ドットをバイオ用蛍光試薬として用いる場合、分散濃度が非常に低いため発光輝度が低く、また、励起光強度が高いために劣化が早いという問題がある。ところが量子ドットの中でCdSe/ZnSコアシェル型量子ドットは励起光をよく吸収するため高輝度化に有利であり、緩衝液中でも比較的安定であることがわかってきた。産総研では、このCdSe/ZnS量子ドットを用いて、高輝度発光と高耐久性(化学的耐久性および耐光性)を両立させ、細胞が食作用で取り込みやすい粒径100 nm以下の量子ドット分散ガラスカプセル蛍光体の開発に取り組んだ。ケイ素アルコキシドの加水分解でガラスを作製するゾル-ゲル法をベースとして、CdSe/ZnS量子ドットを高濃度で分散した高輝度・高耐久性のガラスカプセル蛍光体の作製技術開発を目指した。
本研究は、独立行政法人 科学技術振興機構(JST) 独創的シーズ展開事業 大学発ベンチャー創出推進プロジェクト(平成19-21年度)で実施された。
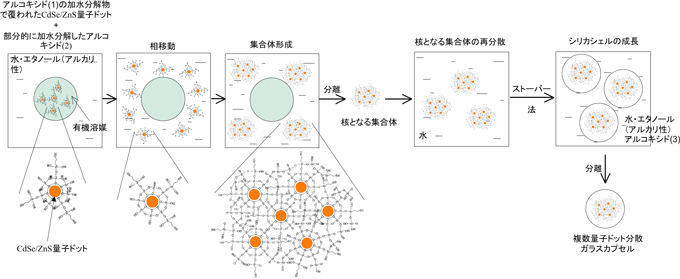
蛍光試薬に求められる要件として、発光が高輝度であること、バイオ用の緩衝液等に希釈分散した場合に劣化や成分の溶出を起こしにくく、強い紫外線(励起光)を照射した際にも光劣化しにくいこと、細胞へ導入しやすいサイズ(100 nm以下)であることなどが挙げられる。高輝度を確保するには、カプセルに10個以上の量子ドットを入れる必要があるため、カプセルの粒径は約20 nm以上となる。私たちは、目的とする粒径20-100 nmのガラスカプセルを得るには、ゾル-ゲル法の1つであるストーバー法が適していることを見いだし、これをさらに改良した。すなわち、量子ドットの発光効率を高く保持したままガラスカプセルに閉じ込めて、耐久性を向上させるために、まず、量子ドットの表面を適切に被覆保護する。その後、表面を被覆した量子ドットの集合体を形成し、その上にシリカを堆積させてガラスカプセル蛍光体を作製した。以下に今回開発した3段階作製法(図1)の詳細を示す。
[ステップ1] CdSe/ZnS量子ドットを含む有機溶媒にケイ素アルコキシド(1)を添加する。ケイ素アルコキシド(1)を部分的に加水分解させ、量子ドットの表面を加水分解物で被覆する(有機溶液A)。一般に量子ドットの発光効率は表面の状態に大きく影響されるが、この被覆によりCdSe/ZnS量子ドットの発光効率の低下を抑えることができた。
[ステップ2] 部分的に加水分解したケイ素アルコキシド(2)を含む水溶液を調製する。これをステップ1で調製した有機溶液Aと混合し、アルコキシド(1)で覆われた量子ドットの表面にアルコキシド(2)の層を形成する。量子ドット表面のケイ素アルコキシドが水に触れて加水分解が進み、親水性となって水相に移動し、同時に集合体を作る。適切な種類や濃度のケイ素アルコキシドを選択して、アルコキシド(2)の加水分解速度がケイ素アルコキシド(1)よりも遅くなるようにして、量子ドットが凝集して大きな塊となることを防ぐ。その結果、量子ドット間の不完全な化学結合の生成等による発光効率低下が避けられる。
[ステップ3] 量子ドットの集合体にさらにシリカ(ガラス)層を堆積させて量子ドット分散ガラスカプセル蛍光体を作製する。これは、ストーバー法により、アルカリ性の溶媒中でケイ素アルコキシド(3)を加水分解させ、量子ドット集合体を核として堆積させることで行う。このステップでは緻密なシリカ層が堆積されて量子ドット集合体を被覆するので、作製したガラスカプセル蛍光体は高い耐久性を備えている。
 |
|
図1 CdSe/ZnS量子ドット集合体を核とした高輝度・高耐久性ガラスカプセルの3段階法による作製
|
今回開発した3段階作製法により、CdSe/ZnSコアシェル型量子ドットの密な集合体を核とし、その上に発達した網目構造をもつシリカが堆積した、粒径20-100 nmのガラスカプセル蛍光体が得られた。このガラスカプセルは、CdSe/ZnS量子ドットを10個以上含んでいる。ステップ1、2で用いるケイ素アルコキシド(1)、(2)の濃度等を制御することで、例えば図2に示すように、粒径40 nmのカプセルと粒径95 nmのカプセルを作り分けることもできる。量子ドットの発光効率は、カプセルに分散させた後も、もとの量子ドットと同程度(20-35 %)であった。透過電子顕微鏡観察およびICP-AES分析により見積もったところ、例えば粒径47 nmのガラスカプセルは25個程度のCdSe/ZnS量子ドットを含むことがわかった。ガラスカプセル蛍光体の発光輝度は量子ドットの発光効率と分散濃度の積に比例するが、今回作製したガラスカプセル蛍光体は発光効率の高い量子ドットを高濃度で含む。これから予想されるように、ガラスカプセルは高輝度の蛍光体であった。
 |
|
図2 多数のCdSe/ZnS量子ドットを分散したガラスカプセル蛍光体の透過電子顕微鏡像。
左:大きなカプセル(粒径95 nm)、右:小さなカプセル(粒径40 nm)
|
このようにして作製したガラスカプセル蛍光体はバイオ用の緩衝液中で10 nM(nmol/L)程度(量子ドットの濃度)まで薄めても成分の溶出が少なく劣化しにくい。また、高濃度の塩を含むHEPES緩衝液中でのガラスカプセルからのカドミウムの溶出量は、市販のポリマーコートCdSe/ZnS量子ドットに比べて10分の1以下と少なく、高耐久性であった。紫外線照射に対する耐光性も、市販のポリマーコートCdSe/ZnS量子ドットに比べて100倍程度高かった。
また、このガラスカプセル蛍光体は表面を化学修飾してカルボキシル基などを導入することも可能であった。これを応用するとガラスカプセル蛍光体表面に抗体を付けることができるので、生体内に存在する特定の分子を観察できる蛍光プローブとなる。
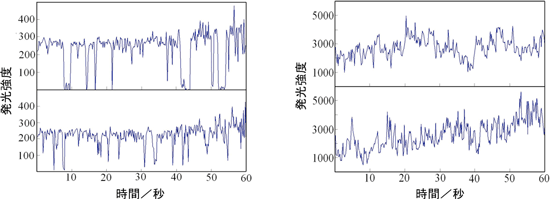
量子ドット1個1個からの発光は点滅することが知られている。蛍光試薬として用いる場合、各輝点が点滅すると、蛍光試薬で標識した物質の移動と混同する恐れがあるので、点滅が少ないことが望まれる。CdSe/ZnS量子ドット1個からの発光と、ガラスカプセル(平均15個のCdSe/ZnS量子ドットを含む)からの発光の時間変化を、蛍光顕微鏡を用いて測定比較した。図3に示すように、量子ドット1個では点滅が明確なのに対して、ガラスカプセルでは、多数の量子ドットが含まれるため、それぞれの量子ドットからの発光が平均化されて点滅が観測されず、発光強度が安定化した。なお、ガラスカプセル1個の発光強度は、量子ドット分散数から予想されるように、量子ドット1個の発光強度の約15倍であった。このように、発光強度の安定性の面からも、ガラスカプセル蛍光体が蛍光試薬として有利であることが確認できた。
 |
|
図3 左:CdSe/ZnS量子ドット1個の発光強度の時間変化(上下各1個の量子ドット) 右:平均15個のCdSe/ZnS量子ドットを含むガラスカプセル蛍光体1個の発光強度の時間変化(上下各1個のカプセル)
|
今後、細胞や生体関連物質を対象とする基礎研究用蛍光試薬から、感染症の迅速診断など臨床応用まで視野に入れたバイオ分野での広い応用を目指して量産性の検討を行い、ベンチャー化に向けた準備を進めつつ、関連メーカーとの連携を図る計画である。また、電子材料用蛍光体としての用途も開拓する。