独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)糖鎖医工学研究センター 成松 久 研究センター長(兼)糖鎖遺伝子機能解析チーム 研究チーム長、グライコプロテオーム解析チーム 梶 裕之 研究チーム長、レクチン応用開発チーム 久野 敦 主任研究員、分子医用技術開発チーム 池原 譲 研究チーム長、国立国際医療センター国府台病院 肝炎・免疫研究センター 溝上 雅史 センター長、名古屋市立大学 大学院 医学研究科 田中 靖人 教授は、肝炎ウイルスの持続感染に伴い、数年単位で変化してゆく肝臓の病態を、定性的かつ定量的に測定できる検査システムの開発に成功した。
本研究成果は、これまで検査入院が必要であったB型やC型肝炎ウイルスに感染した患者の、長期にわたる診断や治療、治療後のフォローアップに関連した身体的・経済的負担を軽減することが期待される。本研究成果詳細は2009年10月1日~3日に横浜で開催の第68回日本癌学会で発表される。
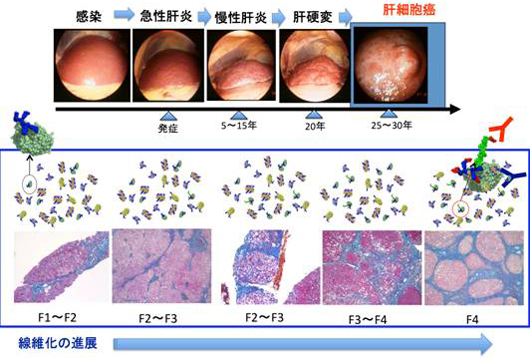 |
がんに向かう肝炎の進行度を、糖鎖解析技術で評価する |
慢性肝炎の診断治療のプロセスにおいて、肝炎ウイルスの持続感染により進む、肝臓の線維化の程度を確定することが必要となり、肝臓の組織病理学的検査(生検:バイオプシー)がしばしばなされる。生検検査は、体外より肝臓に向けて差し込んだ針によって、肝臓組織を採取して行う検査であるために、出血などのリスクもあり、身体的負担が大きい。しかも検査に際して、1週間程度の入院を必要とするので、この間の社会的経済的活動も制約される。日本のB型肝炎、C型肝炎感染者はそれぞれ、100~130万人、150~200万人と推定されることから、当該疾患に関連した社会的、経済的損失は極めて大きいと思われる。これらウイルス性肝炎は、感染から20~25年程度の後に、肝硬変に進展し、肝細胞がんへと至ることが知られている。なお、国立がんセンターの発表するがん統計情報によると、原発性肝がんによって2004年度には34507人が死亡している。肝細胞がん患者の9割以上は、B型やC型肝炎ウイルス感染の既往を持っており、その内訳として、B型感染が約20%、C型ウイルス感染が約70%を占めると報告されている(図1)。
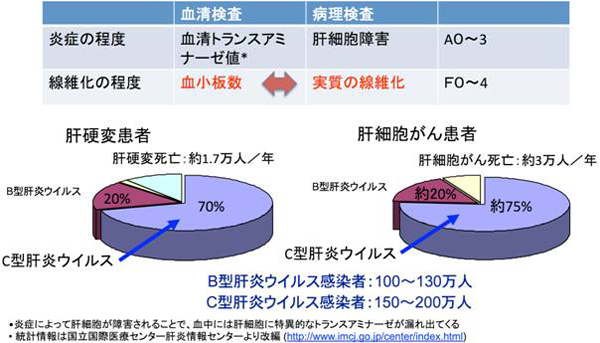 |
図1 技術開発によって解決すべき肝炎の課題(肝炎の病理にマッチした線維化の血清学的探索法)と、肝疾患における肝炎ウイルスの割合 |
冒頭でも記したように、ウイルス性肝炎から肝硬変や肝細胞がんへ至る疾病の進行度は、肝組織における線維化の進展で推し量る。針生検・病理組織診断による直接評価の他、線維化は、線維化の進展に随伴して観察される血小板減少(15万未満)を指標とすることで、「間接的」にも評価される。血清トランスアミナーゼ(ALT)正常C型肝炎例への抗ウイルス治療ガイドラインに示されるように、例えば血小板数が15万未満であれば、その症例は線維化が進んだ患者であると推察する。この場合には肝生検を行って確認することが必要で、線維化グレード3(F3)以下であった場合は慢性肝炎、線維化グレード4(F4)であった場合は肝硬変として対処される。なお、肝細胞がんのリスクは線維化が進むほど高いとされており、肝細胞がんの出現頻度はF3では年率3~4%、F4では年率7~8%である。線維化の進展が想定される症例では、がんのスクリーニングも重要な鍵となる。このような臨床病理学的状況を鑑みると、身体的負担を軽減し、肝臓で進む線維化を直接的に測定できる検査法が必要である。このことは2008年に発表された「肝炎研究7カ年戦略」の目標としても取り上げられている。
開発を進めてきた糖鎖疾患マーカーは、研究背景に挙げた課題解決に向けて、大きな可能性を有するものである。
産総研・糖鎖医工学研究センターでは、独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)からの受託事業として2001年度より、糖鎖研究をバイオテクノロジー開発技術研究組合(バイオ組合)との共同で継続して実施している。2006年度より開始した「糖鎖機能活用技術開発」プロジェクト(以下「MGプロジェクト」という)(プロジェクトリーダー、成松 久)では、糖鎖医工学研究センター内に設置のプロジェクト集中研究サイトにおいて、大学、臨床機関、民間会社等、全国38の研究機関との共同・分担研究も併せ、糖鎖機能の研究開発を実施してきた。その中で糖鎖疾患マーカーの開発を取り上げ、各種のがんについて統一した戦略を用いてマーカーの取得を進めてきており、今回の成果は、国立国際医療センター国府台病院と名古屋市立大学との共同研究において得られた肝疾患マーカー開発の研究成果である。
MGプロジェクトでは、単に存在量が変動するタンパク質を疾患マーカーと見なして探索する従来の戦略ではなく、罹患あるいは疾患の進展の程度に伴って病巣細胞が産生する糖タンパク質上の糖鎖構造が変化することを基軸として、量的および質的変化を示す糖タンパク質を糖鎖疾患マーカーと見なし探索する戦略を考案し、実施している(図2)。
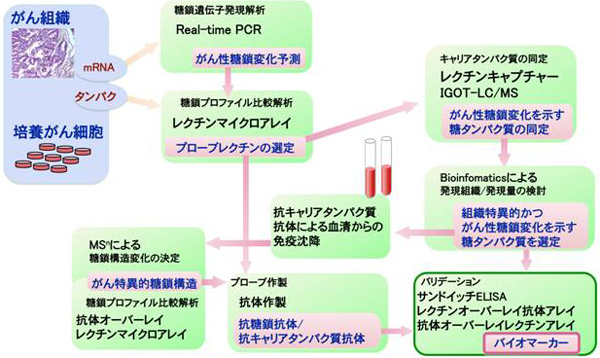 |
図2 がんマーカー探索の戦略 |
この戦略では、1)がん組織や培養がん細胞が産生する糖鎖遺伝子の発現プロファイルから、がん細胞が特徴的に産生する糖鎖構造を推測すると同時に、実際に産生・分泌された糖タンパク質糖鎖をレクチンマイクロアレイ分析し、がん細胞が特徴的に産生する糖鎖に反応するレクチンあるいは抗糖鎖抗体をプローブとして選択する、2)選択されたプローブを用いて、がん細胞分泌糖タンパク質の中からがん性糖鎖を持つ糖タンパク質群(あるいはその断片糖ペプチド)を捕集し、IGOT法などの質量分析を基礎とした方法でそのコア糖タンパク質を同定する、3)同定された糖タンパク質を患者血清より精製し、再度レクチンアレイを基礎とした方法等で糖鎖構造変化を確認する、の3ステップで糖鎖疾患マーカー候補を多数見いだしている。今回、この新戦略を肝炎関連疾患に適用し、見いだされた候補糖タンパク質群の中から、以下の確証実験により肝細胞の線維化の程度を反映する優れた糖タンパク質マーカーが見いだされた。
2008年度に糖鎖疾患マーカー開発におけるマーカー候補分子の検証実験に有効なレクチンマイクロアレイを基盤とした技術(Antibody-assisted lectin profiling (ALP))を確立し、その成果をプロテオミクス専門誌であるMolecular & Cellular Proteomicsに発表した。このシステムは血中に存在する標的糖タンパク質を簡易に精製し、レクチンマイクロアレイによりその糖鎖構造を比較プロファイルできるシステムである。大きな特徴は、数十ng程度の糖タンパク質を生体成分から簡易精製し、比較解析できることである。既存技術である質量分析や液体クロマトグラフィーを用いての比較糖鎖解析の場合、少なくとも10μgの精製糖タンパク質が必要であった。本システムが開発されたことで、血清や組織などに微量にしか存在せずに分析が不可能であった糖タンパク質の比較糖鎖解析が可能になった。また貴重な臨床検体をごく微量だけ使用し分析することが可能になった。
このシステムを活用し、マーカー候補分子である糖タンパク質分子(α1酸性糖タンパク質(AGP))の糖鎖構造変化が、肝線維化の進展を非侵襲的に検査しうるマーカーとなるかを検証した。肝炎患者、肝硬変患者、肝がん患者、および健常者各5例ずつ0.5μLの血清からAGPを簡易精製し、レクチンマイクロアレイによる比較糖鎖解析を行ったところ、シグナルの得られたレクチンのうち、non-LC (慢性肝炎と健常者)およびLC(肝硬変と肝細胞がん)で、顕著な変化を示したレクチン6種を見いだした。そこで、肝炎ウイルスに罹患し、肝生検により線維化の程度(ステージ)が病理診断された患者群125症例(F1:33症例、F2:32症例、F3:31症例、およびF4:29症例)を対象に分析し、統計学的に肝線維化の進展と最も相関があるレクチンをさらに選抜した。その結果、2種のレクチン(AOL, MAL)がF3とF4の間で有意差がある、すなわち慢性肝炎と肝硬変を見分けることがわかった。
この2つのレクチンのブラインドテストを、臨床診断済み慢性肝炎患者45症例および肝硬変患者43症例について実施した。その結果、AOLは、検出力として感度86%、特異度91%、正診率89%となり、MALは、検出力として感度91%、特異度89%、正診率90%となった。さらに2つのシグナルを組み合わせてみたところ、感度95%、特異度91%、正診率は93%という最も確度の高い肝硬変検出結果が得られた。以上より、複数のレクチン(AOL、MAL)とAGP抗体とのサンドイッチ免疫検出をコンビネーション(並列測定)することで、ウイルス性肝炎患者の中から肝硬変に罹患した患者を感度95%、特異度91%、正診率93%で高精度に囲い込むことが可能となることを見いだした。この数値は既報にあるフコース認識レクチンであるAALとAGP抗体を用いたサンドイッチ検出手法による正診率(<80%)を大きく上回るものであり、かつ、現存するいずれの血清マーカーの成績も凌駕するものであった(図3)。
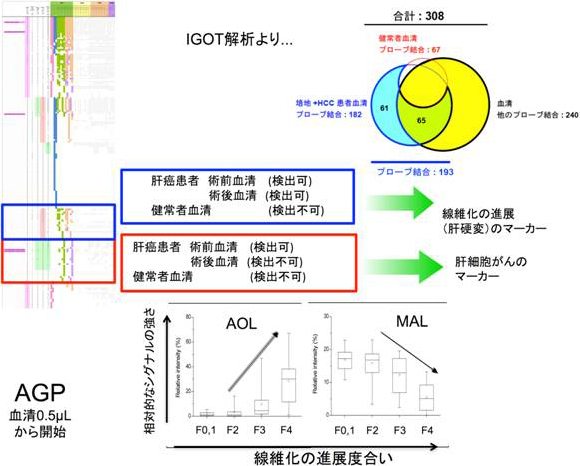 |
図3 糖鎖疾患マーカーの同定と、線維化の進展を捉えるマーカーの例 |
より多くの人々が利用できるように、「研究室レベルでの検出システム」から、「市中病院の臨床検査室で使用可能な検出システム」へと開発を進めている。開発が進めば、複数の臨床機関で採取された多数の検体を解析することが可能となる。これによって、得られた糖鎖疾患マーカーの信頼性と汎用性についての検証を行い、臨床検査として実用化を達成したいと考えている。