独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)セルエンジニアリング研究部門【研究部門長 三宅 淳】大串 始 主幹研究員は、ステムセルサイエンス株式会社 郷 正博 主席研究員(当時)らとの共同研究により、増殖・分化能力の低下したヒト間葉系幹細胞に単一の遺伝子を導入することで、増殖能と分化能(骨分化)を回復することに成功した。
現在、産総研の技術によって、患者自身の骨髄等から得られた間葉系幹細胞が骨や心臓などの再生医療に用いられつつあるが、増殖・分化能力が採取後数週間で激減するので、再生医療への応用を狭めている。今回、増殖と分化能の低下したこのような幹細胞に、レトロウイルスを用いてNanog あるいは Sox2という胚性幹細胞(ES細胞)で発現している遺伝子を導入した。
Nanog遺伝子を導入した細胞は元の細胞と同様、あるいは元以上の増殖と骨への分化能力が回復した。Sox2遺伝子だけを導入した細胞では回復は見られなかったが、b-FGFというタンパク質と一緒に培養すると増殖能と骨分化能の回復が見られた。
今回用いた細胞はすでに臨床応用されている冷凍保存細胞であるので、早期の臨床応用が可能な成果であり、再生医療の可能性が大幅に拡大されると期待される。
本研究内容は、近々米国の科学雑誌Experimental Cell Researchの電子版に公開される。
種々の臓器障害に対して臓器移植が行われているが、ドナー不足は深刻である。例えば、心臓移植のドナーは日本では不足し、海外にドナーを求めて移植を受ける患者が増え、社会問題となっている。解決策として、患者自身の骨髄などから得られる間葉系幹細胞を用いての再生医療がすでに一部で始まっている。
最近、京都大学の山中 伸弥 教授は、皮膚の細胞に4つの遺伝子(Oct4、Sox2、Klf4、Myc)を導入することにより、多分化能を持つES様細胞(iPS細胞)作製に成功した。また、米国ウィスコンシン大学のグループでも4つの遺伝子(Oct4、Sox2、Nanog、Lin28)を導入することにより、やはりES様細胞の作製に成功している。これらの結果は複数の遺伝子導入によって細胞機能の改変が可能であることを示した画期的な成果である。しかし、複数の導入遺伝子の発現を人為的に長期にわたってコントロールすることは極めて難しい。また、これら人為的に作製されたES様細胞は移植によってテラトーマという腫瘍を発生する可能性も高く、臨床応用までには解決されなければならない課題も多い。
産総研では、2001年より患者自身の骨髄に含まれる多分化能を有する間葉系幹細胞を培養増殖・分化させ、すでに共同研究先の大学病院等において骨・関節疾患あるいは心疾患の患者に移植されている。しかし、患者の中には自身の幹細胞の増殖・分化能力が低く、予定の細胞数に達せず、治療の中止を余儀なくされることもある。
このような状況のもと、われわれは間葉系幹細胞の分化能を維持したまま増殖能を高める研究を約3年前よりステムセルサイエンス株式会社とともに開始した。方法論としては、胚性幹細胞(ES細胞)で活発に発現している遺伝子を間葉系幹細胞に導入することにより、増殖能が維持されるかの検討を行ってきた。
今回のわれわれのアプローチは単一遺伝子の導入により細胞の機能が回復することを示しており、さらに、用いた細胞はすでに臨床応用されている冷凍保存細胞であるので、早期の実用化(臨床応用)が可能な成果である。
産総研にはドナーの同意のもとに、ヒト骨髄から得られた間葉系幹細胞が冷凍保存されている。このヒト間葉系幹細胞を解凍し、Nanog あるいはSox2遺伝子を組み込んだレトロウイルスをこれらの細胞に作用させた。そのうち遺伝子の導入された細胞のみを選択して、さらに数週間培養した。
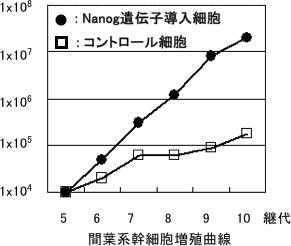
遺伝子導入されていないコントロール細胞では増殖能は低下し、培養約3週~6週(10継代)で10倍ほどしか増殖しなかった。一方Nanog遺伝子を導入されたものでは、約1000倍に増殖した。すなわち、Nanog遺伝子を導入することにより数百倍増殖能が高まった(図1)。
このNanog遺伝子導入細胞を分化誘導因子と共に培養すると、骨細胞に分化した。コントロール細胞ではほとんど分化しなかった(図2、赤色の細胞が骨分化した細胞)。この能力(骨分化能)はコントロール細胞に比し約100倍高かった。以上より、Nanog遺伝子を導入することにより、ヒト間葉系幹細胞は増殖能ならびに分化能とも約100倍の活性を示すことが確認できた。
また、Sox2遺伝子のみの導入では効果を示さなかったが、b-FGFというタンパク質と一緒に培養すると増殖能と分化能を回復した。
 |
|
 |
図1 間葉系幹細胞の増殖曲線
|
|
図2 間葉系幹細胞の骨への分化
(骨細胞だけを赤く染める色素で染色) |
今後は、遺伝子導入の方法等の改良を行い、2010年をめどに種々の難治性疾患患者への移植(臨床応用)を目指す。