独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)糖鎖工学研究センター【センター長 地神 芳文】糖鎖生合成チーム 地神 芳文 研究チーム長、横尾 岳彦 主任研究員、梅村 真理子 テクニカルスタッフ および 独立行政法人 日本学術振興会 藤田 盛久 特別研究員は、細胞表層の特定の場所に特定のタンパク質を正しく輸送し留めるための新たなメカニズムを発見した。
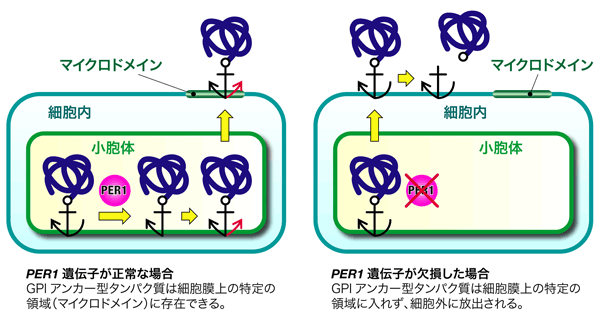
細胞膜にあるべきタンパク質を細胞膜の正しい位置に繋ぎ留めておく機構の一つに、GPIアンカーという、碇の役割をする糖脂質がある。GPIアンカーで繋ぎ留められたタンパク質(GPIアンカー型タンパク質)は、細胞表層におけるシグナル伝達などに重要な役割を果たしている。シグナル伝達の異常は、発がんと密接な関係がある。この研究では、タンパク質に結合したGPIアンカーの脂質部分を合成する新たな遺伝子を発見し、この遺伝子が異常になると、GPIアンカー型タンパク質が細胞表層のあるべき特定の領域に存在できなくなることを示した。
この現象は発がんのメカニズムにも関与していることから、がんの早期発見や治療に道を開くものと期待される。
本研究の詳細は、平成18年10月4日に、米国の国際雑誌『細胞の分子生物学』(Molecular Biology of the Cell)電子版に掲載された。
タンパク質はすべて細胞内で合成され、消化酵素や血液成分のように細胞外に分泌されて働く物もあるが、細胞表層の細胞膜に局在しているタンパク質もある。これら細胞膜に局在しているタンパク質は細胞内外とシグナル伝達やエネルギーのやりとりをしており、がんや病気の発生と密接な関係がある。創薬のターゲットとされるタンパク質も実はほとんどが細胞膜に局在しているタンパク質である。タンパク質が正しく機能するためには、それがあるべき場所に正しく輸送され、その場所に留まることが必要である。
タンパク質の細胞膜への局在化に重要な役割を果たしているもののひとつとして、GPIアンカーが挙げられる。GPIは糖脂質の一種で、細胞膜に局在するタンパク質の一部は、GPIを介して細胞表層の膜に繋ぎ留められている。このようなGPIアンカー型タンパク質は、細胞表層におけるシグナル伝達などに重要な役割を果たしている。
細胞表層の膜は決して均一な構造ではなく、そこにはマイクロドメインあるいは脂質ラフト(「いかだ」の意)と呼ばれる、物性が異なる領域が存在している。GPIアンカー型タンパク質は、このマイクロドメインを構成するものの一つであることが、これまでに示されている。
GPIは細胞のがん化にも関与していることが、ここ数年のうちにわかってきた。たとえば、GPI合成系の、GPIをタンパク質に転移する過程の酵素が異常に亢進すると、がん化が引き起こされることが今までに報告されている。しかしながら、そのメカニズムについては不明のままであった。
以上の背景を踏まえ、産総研では、GPIアンカー型タンパク質の合成メカニズムの研究を行ってきており、特に出芽酵母をモデル系とした研究においては、世界をリードする研究室の一つとなっている。近年は、GPIアンカー合成系におけるアシル基の除去というステップが、タンパク質の品質管理と密接に関わっていることなどを明らかにし、また、膜タンパク質のマイクロドメインへの局在化にGPIアンカー型タンパク質が重要な役割を果たしていることを明らかにしてきた。
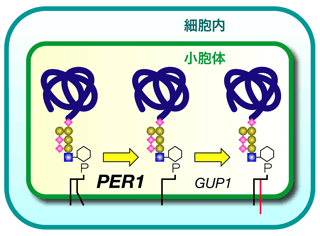
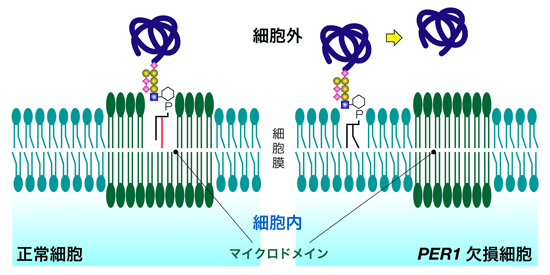
図1に示すように、これまでGPI脂質の初期の脂質成分と最終の脂質成分が異なることは脂質リモデリングとして知られていたが、どのようにしてこの脂質のリモデリングが進むのか、そのメカニズムやその生理的役割は不明であった。これを解明するために、私たちは出芽酵母の細胞を用いて関連した遺伝子の取得を試みた。その結果、機能未知の新規遺伝子PER1を取得し、この遺伝子の機能を解析することにより、PER1は脂質リモデリングの過程において、脂質の2本の足のうち1本を置き換えるための、足の除去の過程に関与していることを明らかにした。GPI脂質リモデリングの最初の過程が初めて明らかにされた。またPER1遺伝子の欠損により足の除去の過程が異常になると、GPIアンカー型タンパク質本体がマイクロドメインに局在できず、細胞外に放出されてしまうことも見出した(図2)。GPIの脂質リモデリングの生理的役割はこれまでは不明であったが、本研究により、脂質リモデリングはGPIアンカー型タンパク質がマイクロドメインに局在するために不可欠な機構であることが明らかになった。
 |
|
図1 正常PER1遺伝子の機能。GPIアンカー型タンパク質の脂質リモデリングにおいて、脂質の「足」の除去に関わっている。 |
 |
|
図2 脂質リモデリングとマイクロドメインとの関係。PER1遺伝子が欠損し、脂質リモデリングが異常になると、GPIアンカー型タンパク質はマイクロドメインに局在できなくなる。 |
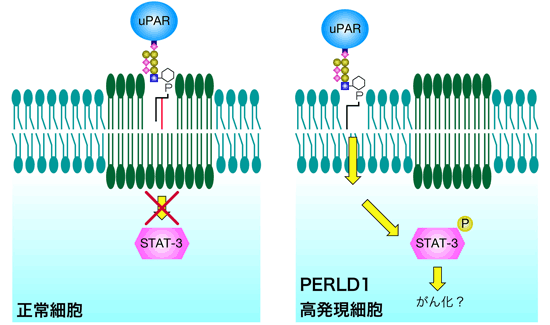
ヒト細胞にもPER1に似た遺伝子としてPERLD1が存在しており、乳がんや胃がんの細胞においては、PERLD1遺伝子の発現が異常に亢進していることがこれまでに示されていたが、その生物機能や生理的役割については今までは不明であった。私たちは、ヒトPERLD1遺伝子が出芽酵母PER1遺伝子と同様の機能を持っていることを明らかにした。このことは、細胞のがん化のメカニズムに新しい知見を与えるものである。すなわち、PERLD1遺伝子の異常により脂質リモデリングが異常になると、GPIアンカー型タンパク質がマイクロドメインに局在化することができなくなる。マイクロドメインはシグナル伝達の場としても機能するため、GPIアンカー型タンパク質を失ったマイクロドメインはシグナル伝達をかく乱し、その結果細胞はがん化すると考えられる(図3)。
 |
|
図3 PERLD1高発現細胞の発がんモデル。PERLD1活性の異常亢進により、uPARなどのGPIアンカー型タンパク質の脂質リモデリングが異常となり、マイクロドメインに局在できなくなった結果、細胞外からのシグナルを過度に伝達してしまうと考えられる。タンパク質STAT-3-Pは多くの遺伝子の働きをon/offするスイッチの役割をする。 |
今回の発見は、以下のようなものに応用できると期待される。
(1) ヒト細胞の脂質リモデリング異常を検知することにより、がんの早期診断や進行度の判定が可能となる。
(2)
PER1遺伝子産物の活性測定系などを利用し、このステップを阻害するような化合物の探索により、抗がん剤の有用な候補化合物のスクリーニングが可能となる。