独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)実環境計測・診断研究ラボ【ラボ長 坂本 満】の大庭 英樹 主任研究員とルミアナ バカロヴァ 招聘研究員らは、これまでにない優れた特性を有する蛍光性量子ドットを新たに合成し、この量子ドットを用いてタンパク質やDNA/RNA計測用のナノバイオハイブリッド材料の開発に成功した。さらに、この新材料が抗体を用いた微量タンパク質検出法(イムノブロット法)に応用できる事を世界に先駆けて明らかにした。
量子ドットは、半導体無機材料でできた数nm(ナノメートル:10億分の1メートル)の粒子であり、紫外線を照射すると強い蛍光を出すところから、バイオイメージング、バイオ計測、光増感剤などの光学材料として世界的に注目を集め、熾烈な研究開発競争が展開されている。産総研は、1)高い発光性 2)有効なサイズ分布 3) 優れた光化学的安定性 4)非凝集性 5)非点滅現象 などの性質を併せ持った優れた量子ドットを調製することに成功した。さらにこの量子ドットにタンパク質アビジン又は生体物質ビオチンを結合させた量子ドットを合成し、両者の組み合わせにより、抗体を用いたタンパク質の検出感度を飛躍的に向上させることに成功した。
 |
量子ドットが発する蛍光
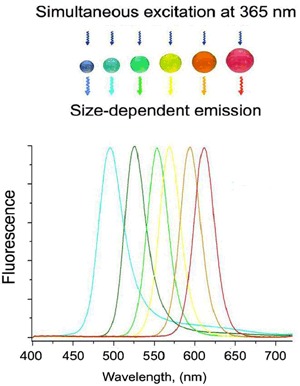
サイズが小さい(2nm)と青色の蛍光を発し、3nmでは緑色、4nmでは黄色、サイズが大きい(5nm)と赤色の蛍光を発する
励起波長は365nm
|
今後、この技術を天然タンパク質の検出・同定を行う電気泳動チップの開発に応用していきたい。また、醸造を含めた食品製造プロセスで生成・侵入する望ましくない菌類や異物を特異的に標識化する量子ドットの表面処理技術を開発し、最適プロセス管理を行うための評価技術にも応用する予定である。
この成果はアメリカ化学会発行のJournal of American Chemical Society, 2005, 127(26), 9328、及びAnalytical Chemistry 2006, 87(1), 321に掲載された。また、2/21-2/23に東京ビックサイトで開催されるナノテク-2006において発表する予定である。
抗体を用いて狙ったタンパク質を検出するイムノブロット法は開発されて既に20年以上になるが、現在でも分子生物学や医学の分野において、細胞や組織中のタンパク質の発現を検出するための主要な方法である。特にゲノム機能解析や全タンパク質(プロテオミクス)解析におけるマイクロアレイ技術の基本となる方法の1つである。イムノブロット法は幅広く長い間利用されているにも関わらず、技術的に大きな改善はなされておらず、次のような問題点がある。1)定量性に欠ける、2)操作工程が煩雑で長時間かかる、3)再現性に乏しい、4)微量タンパク質を検出するには感度が低すぎる、5)細胞溶解液からの直接検出が出来ない、6)タンパク質の沈殿・濃縮などの前処理を必要とする、などである。
この10年~15年、有機系蛍光色素を生産している企業はイムノブロット法におけるタンパク質の蛍光検出にタンパク質アビジンと結合した有機系蛍光色素を推奨してきた。しかしながら、この方法は次のような有機系蛍光色素の持つ欠点により汎用化するには至らなかった。
-
有機系蛍光色素がすぐに退色する;蛍光測定中にその蛍光シグナルが変化し、定量困難。
-
多くの有機系蛍光色素を局所領域に集積させた場合、蛍光シグナルの自己消光がおこり顕著に蛍光シグナルが減少する。
-
タンパク質に対しては通常1分子の有機系蛍光色素によってラベル化されるべきであるが、それでは解析感度をかなり制限することになる。
これらの理由から、イムノブロット法の新しい技術開発が望まれていた。そこで、我々は蛍光性であるだけではなく、ナノ粒子でもある量子ドットに着目した。量子ドットを様々な別の無機/有機材料で被膜化すると、たとえ高濃度に集積しても蛍光は自己消光されない。また、生体分子ビオチンがタンパク質アビジンと非常に強い結合能力を持っていることに着目し、量子ドット-ビオチンと量子ドット-アビジンを合成すれば、多数の量子ドットをサンドイッチタイプに集積できると考えた。これによって狙ったタンパク質の局所領域に多数の量子ドットを集積でき、目的タンパク質の蛍光シグナルを増幅することが可能となると考えた。
合成した量子ドットは、セレン化カドミウム(CdSe)という材料で、直径は僅か3~6nm(ナノメートル:10億分の1メートル)である(図1)。これに紫外線を照射すると、それぞれのサイズに応じて鮮やかな青色から赤色の蛍光を発する。この量子ドットはシャープな蛍光スペクトル(図2)を有しており、バイオイメージング等において非常に有利な特性である。
|
|
|
図1 合成した量子ドットの高分解透過電子顕微鏡写真
今回合成した量子ドットのうち、サイズが3nmのものを示す
|
|
|
 |
|
|
|
図2 量子ドットのサイズに依存した蛍光スペクトル
|
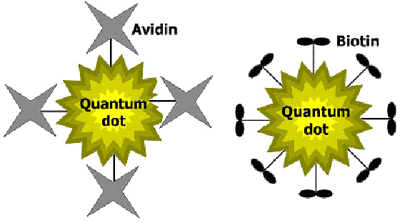
我々は、量子ドットに様々な生体分子を結合させる技術を開発し、これを利用してタンパク質アビジンや生体分子ビオチンと量子ドットを結合した材料を合成した(図3)。
 |
|
図3 アビジン及びビオチンを結合した量子ドットの模式図
左、量子ドット-アビジン 右、量子ドット-ビオチン
|
次にこの材料をビオチン標識した抗体と組み合わせて、イムノブロット法と呼ばれるタンパク質の検出技術に応用した。
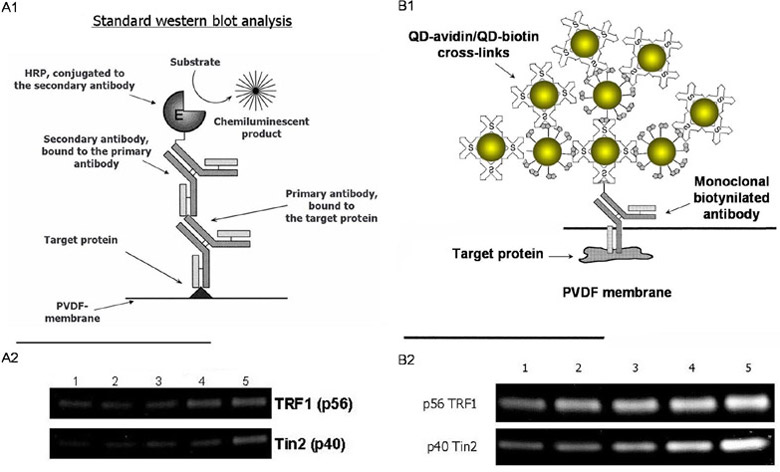 |
図4 細胞中に存在する微量タンパク質(TRF1、Tin2)の検出
左、従来のイムノブロット解析法 A1;スキーム、A2;TRF1およびTin2のバンド
右、量子ドット使用イムノブロッテング解析 B1;スキーム、B2;TRF1およびTin2のバンド
番号は細胞溶解液中での次のそれぞれの目的タンパク質の濃度を示す。
1:10µg 2:20µg 3:30µg 4:40µg 5:50µg.
TRF1:Telomeric Binding Factor (56KDa)
Tin2:TRF1-interacting nuclear Protein 2 (40kDa) 、
いずれも慢性骨髄性白血病細胞中に極僅かにしか存在しないタンパク質。 |
|
その原理は図4B1に示すように、まず抗体は標的タンパク質を特異的に認識してこれに結合する。次に抗体に標識されているビオチンに1個の量子ドット-アビジンが結合する。そのアビジンには量子ドット-ビオチンが結合する。そのビオチンに次の量子ドット-アビジンが結合する。これを繰り返すと抗体上に多数の量子ドットが順次集積され蛍光強度が増強される。図4では従来のイムノブロット法 (A1、化学発光検出)と今回開発した量子ドットを利用した新規イムノブロット法(B1、蛍光検出)の原理をそれぞれ模式的に表している。
この方法により細胞分裂に係わるTelomeric Binding Factor (TRF1、56KDa)とTRF1-interacting nuclear Protein 2 (Tin2、40kDa)の2種類のタンパク質の検出を行った。これらは慢性骨髄性白血病細胞に90%以上の割合で発現しているが、ごくわずかにしか存在していないタンパク質である。対照の解析法として、従来の化学発光を用いたイムノブロットを行った。
その結果、従来のイムノブロット法では検出が不可能であった(図4A2)微量タンパク質を、量子ドット使用イムノブロッティング解析法では高感度に検出できることがわかった(図4B2)。
さらに、量子ドットシグナルは市販の蛍光測定装置中で連続測定した場合でも約40分間は安定であり、解析や検出データの取得にも適していることが分かった。また、4℃で遮光しておけば、蛍光シグナルに大きな変化は見られず、数週間は安定である。
これらの結果は量子ドットを用いた“サンドイッチタイプ”イムノブロット法が微量タンパク質を検出する技術として、従来のイムノブロット法よりも優れていることを示唆している。
国立大学法人 名古屋大学 応用化学科 馬場 嘉信 教授(産総研 健康工学研究センター 副センター長)と共同でこの新規に開発した量子ドットイムノブロティング解析技術をマイクロチップ電気泳動による天然タンパク質の検出と同定を行うための電気泳動チップの開発に応用する予定である。また、醸造・発酵を含めた食品製造プロセス過程で生成あるいは侵入する望ましくない菌類や異物に特異的に標識化する量子ドットの表面処理技術を開発し、最適プロセス管理を行うための評価技術にも応用する予定である。