独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)ジーンファンクション研究センター【センター長 多比良 和誠】、米国ソーク研究所【所長 リチャード マーフィー】のFred H. Gage教授らの研究グループは、ニューロン新生(ニューロジェネシス)の運命決定を制御する新規のRNAを世界で初めて発見した。このRNAは、約20塩基の二本鎖という形状を持つ非常に小さい分子ながらも、神経細胞(ニューロン)の分化の際に重大な役割を果たす。このRNAはニューロンの遺伝子発現を抑制する負の転写因子であるNRSF/RESTタンパク質によって認識されるNRSE/RE1の配列を持っており、このタンパク質および遺伝子の設計図であるDNA上のNRSE/RE1配列と相互に作用することによって、ニューロン遺伝子群の発現を引き起こす。その結果、未分化状態だった神経幹細胞はいくつかの分化経路の中から、特異的にニューロンへと分化の道をたどるようになる。
このRNAは細胞の核内に存在し、遺伝子発現の初期段階である転写過程をDNAおよびタンパク質との相互作用により制御する役割を持つ、全く新規のRNAである。小さなnon-coding RNAがもつ細胞の働きを制御する役割の場が、もっと拡張されることを示唆することとなった。
※本研究成果は、米国の科学雑誌「Cell」の3月19日号に掲載された。
|
|
|
図 NRSE dsRNA(smRNA)による活性化モデルの概要
|
|
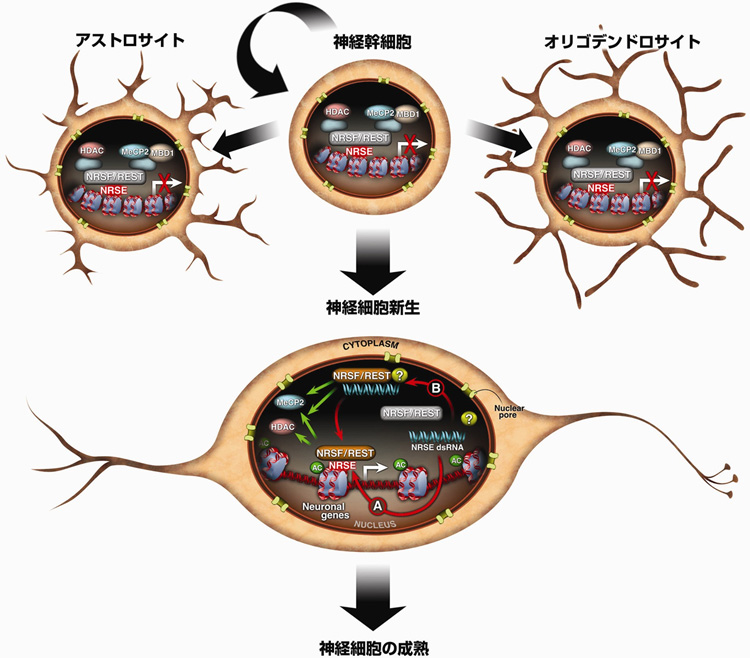
ニューロンの特性にとって重要な因子のひとつにNRSF/RESTによって認識されるNRSE配列がある。未分化細胞である神経幹細胞・アストロサイト(astrocyte)・オリゴデンドロサイト(oligodendrocyte)ではNRSF/RESTがNRSE配列に結合することによりニューロン関連の遺伝子抑制を行っている。NRSF/RESTは、遺伝子発現を抑制するために、HDACおよびメチル化DNA結合タンパク質(MeCP2、MBD1)のような負の転写因子を使っている。神経系へ分化(ニューロジェネシス:neurogenesis)させるには、神経幹細胞・アストロサイト・オリゴデンドロサイトに特異的な遺伝子を抑制し、ニューロンに特有のNRSEマークされた遺伝子の転写を活性化する。これらの細胞では、NRSE配列とdsRNAを形成することのできるnon-coding RNA(smRNA)が供給されている。このsmRNAの発現によりNRST/RESTのニューロジェネシス活性因子と抑制因子としての働きが調整されている。このとき、NRSF/REST 自身の発現量は変えることなくNRSE依存的に転写レベルでの遺伝子制御が行われている。
|
脳内に海馬と呼ばれる部位がある。脳のほぼ中央に小さく包まれて位置するこの海馬は、人の記憶機能を制御する場所である。驚いたことにこの海馬がなくても人は生きてはいけるが、ただ新しい記憶を全く得ることができない。人を定義づける人格にとって記憶形成は不可欠で、日々の記憶の貯蔵にたくさんのニューロンが複雑にネットワークを築き上げながら貢献している。海馬は脳内で1、2を争うほどニューロジェネシスが頻繁に起きる場所である。ここにはニューロンになるもととなる神経幹細胞が存在し、この未分化な幹細胞からニューロン、オリゴデンドロサイト、アストロサイトという3種類の成熟細胞ができあがる。どの細胞に分化するかは細胞外からのシグナル、および細胞内での特異的な遺伝子の発現など様々な現象が重なって最終的な経路が決定される。
様々な生物のDNA配列情報が解読・整備されている現在、この膨大な情報の中から効率よく目的とする有用遺伝子群の同定・解析ができる手法の開発は必須である。我々は、RNAを配列特異的に切断するリボザイムに着目し、網羅的な機能遺伝子探索法(ジーンディスカバリー技術)を確立した。今回、このリボザイムを用いてニューロン新生の鍵となる小さなRNAの役割を同定した。
我々が世界で初めて発見し、smRNA(スモールモジュラトリーRNA)と名付けた新機能性の小さなRNAは、細胞の核内で遺伝子情報をコードする設計図であるDNAと、その設計図上にやってきて特定の遺伝子の発現のOn/Offを制御する機能性蛋白質(転写因子)の双方に作用する、全く新しい部類のRNAモジュレーターである。DNA設計図上に配列特異的(NRSE/RE-1と呼ばれるニューロン特異的な遺伝子にコードされた配列)にこのsmRNAがやってくると、「この配列の下流にコードされた遺伝子(産物)を今から生産開始しなさい」という命令がはいり、それまでその部位で遺伝子の発現を押さえていたリプレッサー(抑制)タンパク質(NRSF/RESTタンパク質)が、その性質を変えアクチベーター(活性化)タンパク質に化ける。その結果、神経幹細胞をニューロンへと導いていくのに必要な多くの遺伝子の発現が始まり、ニューロジェネシスが起こる。このsmRNAはDNA設計図上で発現場所を指示すると同時に、既にある1つの重要な蛋白質の性質を全く別の性質へ変化させる役割をもつ。特定の遺伝子群の指定、タンパク質の二面性のコントロール、の指示を出し終えると、成熟ニューロンへと神経幹細胞が進行する前にこのRNAは密やかに姿を消してしまう。
神経幹細胞に未分化状態であることを提示するリアルタイムマーカーを導入し、ニューロン分化を強制的に促すシグナルを与えると神経幹細胞がニューロンへの分化経路を歩み始め、神経幹細胞のマーカーは時間を追って消滅していく。ここに、この小さなRNAを切断する機能を持つリボザイムを導入すると、神経幹細胞からニューロンに分化せず未分化の状態のままで神経幹細胞がとどまり、このsmRNAの役割を同定する過程で、我々のリボザイム技術が非常に役立った。
近年、同様の小さい二本鎖のRNAが、細胞の中の別空間である細胞質で蛋白質生成の最終段階である翻訳過程を阻害する現象が見つかっている(miRNA, siRNA)。今回のsmRNAはDNA遺伝情報がつまった細胞の見つけにくい核内での、遺伝子発現の初期段階である転写過程を制御するRNAの発見であり、産総研と米国ソーク研究所の幹細胞技術を組み合わせることによって初めて可能になった発見である。このような、核内の小さなRNAが、我々の遺伝子上にどれだけあり、そして何処に隠されているのかを明らかにするために、今後更に研究を進めてゆく。