国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)環境管理研究部門【研究部門長 田中 幹也】金 誠培 主任研究員と慶應義塾大学【学長 長谷山 彰】(以下「慶大」という)理工学部【学部長 伊藤 公平】応用化学科 鈴木 考治 名誉教授、ダニエル チッテリオ 教授、西原 諒(博士後期課程)は、生物発光酵素に極めて選択的に明るく発光する一連の基質類の新規合成に成功した。
従来、生物発光酵素は、おおむね同じ発光基質を共有することが常識であった。例えば、ホタルを含む昆虫由来の生物発光酵素類は一般的にD-ルシフェリンを共通の基質とする。しかしこのような発光特性は、バイオアッセイで2つ以上の生物発光酵素を用いることを難しくする。例えば、2つ以上の生物発光酵素が共通の基質を光らせた場合、互いの発光スペクトルが重なるため、発光信号のコンタミが起こる。従来の光学フィルターでは、完全な発光信号の分離は困難であり、分離できたとしても発光輝度を弱める問題点があった。もしバイオアッセイで多数の発光酵素を同時に用いることができれば、高いサンプル処理能など、バイオアッセイの効率を大きく高めることができる。
共同研究チームは、これまでの常識を覆す新たな挑戦として、発光酵素に対してそれぞれ選択的に発光する発光基質類の分子設計と開発に成功した。その結果、バイオアッセイにおいて汎用(はんよう)的に用いられているウミシイタケ由来の発光酵素(Renilla luciferase; RLuc)類や発光プランクトン由来の人工生物発光酵素(artificial luciferase; ALuc®)類に選択的に発光する基質類の合成と生細胞実証に成功した。この研究成果は、Scientific Reports誌(Nature Publishing Group) に2017年4月19日版でオンライン掲載された。
 |
|
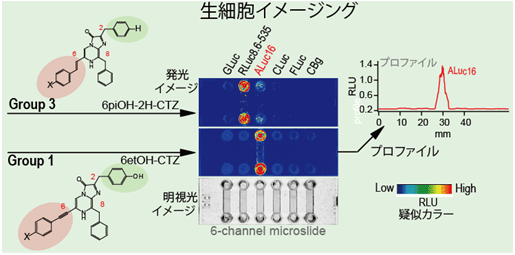
生きた動物細胞(アフリカミドリサルの腎臓由来)を用いた生物発光イメージング実験。多様な発光酵素を発現する形質変換細胞をマイクロスライドに培養した。本研究で開発した発光基質をマイクロスライド全部に振りかけても、特定発光酵素しか光らないことが分かる。比較に用いた発光酵素名:GLuc、ガウシア生物発光酵素;RLuc8.6-535、ウミシイタケ生物発光酵素;ALuc16、人工生物発光酵素;CLuc、ウミボタル生物発光酵素;FLuc、ホタル生物発光酵素;CBg、緑色コメツキムシ生物発光酵素。Group 1およびGroup 3とは、図2(A)の分類表のグループを指す。 |
ホタル発光として代表される生物発光は、バイオアッセイを中心に広く一般的に使われている。生物発光を放つ顕著な例がホタルであるが、その他にも発光プランクトン、ウミシイタケなど、自然界には多くの発光性生物が生息している。これらの生物発光は、一般的に生体に無害でありながらも、明るく、光学フィルターが要らないため検出装置の小型化に有利であり、昔からバイオアッセイや各種診断キットの発光標識として利用されてきた。
一方、発光と共に産・学全般に広く用いられている発光標識として蛍光がある。オワンクラゲから単離された蛍光タンパク質類が特に有名である。しかしながら、蛍光信号を誘発するためには、励起光の照射が必ず必要である。しかし、蛍光は励起光のごく一部が蛍光信号に転じるだけであり、その残りほとんどはそのままバックグラウンドになるため、非常に効率の悪い系である。さらに励起光の一部は蛍光信号に紛れ込んでコンタミさせたり、強い励起光照射(一般的にレーザーを使う)による生体破壊の問題点もある。このため、バックグラウンド蛍光は常に高く、必ず励起光発振装置と光学フィルターを装備する必要があるため、検出系が煩雑になる。これらの制限に加え、励起光の照射が困難な系(生体深部など)、本来脂溶性環境のような蛍光バックグラウンドがそもそも高い系(胚、脂肪組織など)、小型診断試薬系(小型化)などにおいては、その使用が困難である問題点があった。
生物発光は長い歴史にも関わらず、その産業利用を妨げるくつかの弱点があった。例えば、生物発光は、蛍光とは異なって、発光スペクトル(半値幅)が太いため(図1(A))、異なる発光信号間のコンタミ(クロストーク)が起こりやすい。また発光には基質という化学物質を必要とするが、発光酵素が使える発光基質の種類は少なく、複数の異なる発光酵素が同じ発光基質により光る問題がある。例えば、ホタルを含む昆虫由来の発光酵素類は一般的にDルシフェリンを共通の基質とする。同様に、ウミシイタケを含む海洋生物由来の発光酵素類は、多くの場合セレンテラジンを共通の基質とする。また発光色も多様ではない:例えば、ほとんどの発光色は、青色―緑色領域の光を放ち、黄色より長波長発光するケースは極めて少ない。まれに赤色発光するケース(鉄道虫など)もある。海洋生物由来の発光酵素にとりわけこの傾向が強い。
この生物発光の特徴(太い半値幅、限られた発光色)により、二つ以上の発光酵素からなるバイオ系において、発光信号間の一定水準のコンタミはやむをえないものと思われてきた。この問題を解消するために光学フィルターを用いて色を分けることもできるが、この場合、発光輝度が大幅に弱められ、検出光学系を複雑にする短所があった。
これらの問題点は、生物発光を利用する場合に頻繁に起こるものであり、生物発光を用いる限り回避することが極めて困難とされていた。
なお本研究は、科研費基盤A、基盤B、挑戦的萌芽研究など(以上、日本学術振興会)の研究支援を受けて行ったものである。
 |
|
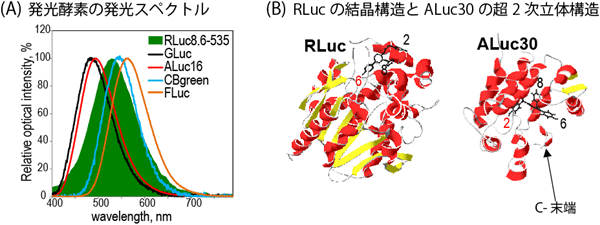
図1(A)代表的な生物発光酵素の発光スペクトル。主に青‐緑色領域で発光するが、基質との組み合わせによっては、600nm以上の赤波長領域で発光する場合もある。(B)海洋生物由来の生物発光酵素(ウミシイタケ生物発光酵素(RLuc)、人工生物発光酵素(ALuc30))の超2次立体構造。同じ基質(セレンテラジン(CTZ))に対して、それぞれの発光酵素の結合モデルが異なる。 |
当共同研究チームは、生物発光が持つ、前述した根本的な問題点の解決策として、各発光酵素に特異的に発光する基質の開発に取り組んできた。
まず、発光プランクトン(カイアシ類)由来の人工生物発光酵素(ALuc®)がもつ超2次立体構造に注目した(図1(B);参考論文1)。この立体構造の分析により以下のことが分かった:酵素活性部位がC末端から近い。また「基質のC-2残基」は相対的に酵素活性部位の深部に位置する一方、「基質のC-6残基」は、酵素活性部位の入り口付近に位置する。これは、「基質のC-2残基」は酵素活性部位とがっちり結合する半面、「基質のC-6残基」は比較的に緩く結合することを示唆する。一方、今まで知られていたRLuc8の立体構造は、反対であった:すなわち、「基質のC-2残基」は緩く、「基質のC-6残基」は固く酵素活性部位と結合していた(参考文献2)。
このような、生物発光酵素が持つ構造的特徴は、「基質のC-2残基またはC-6残基」を調整することにより、発光酵素に特異的な発光基質を作ることができることを示唆する。
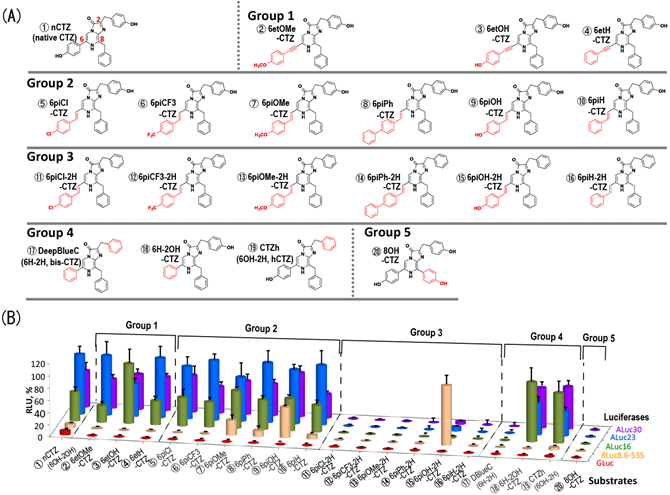
そこで、図2(A)に示したように、20種類の発光基質を合成し、その発光特性を動物細胞に発現した発光酵素類を用いて調べた。その結果、図2(B)で示す結果を得た。すなわち、それぞれの発光基質は、各発光酵素に異なる選択性を示す。例えば、発光基質②、③、④は人工生物発光酵素類(ALuc®)と特異的に発光する反面、発光基質⑮はウミシイタケ発光酵素(RLuc8.6-535)のみに選択的に発光する。発光基質⑨は、ALuc®とRLuc8.6-535の両方共に強く発光することが分かった。
 |
|
図2 (A)合成した発光基質の化学構造。赤色のところが、本来の発光基質(ネイティブセレンテラジン)と異なる官能基である。(B)合成した発光基質による発光酵素の相対的発光強度。便宜上、合成発光基質を、その化学構造によって5つのカテゴリーに分類した。:グループ1はC-6位にエチニル基を含む。グループ2の特徴は、C-2フェニル環にヒドロキシル(OH)基を有することが特徴である。ウミホタル発光酵素(RLuc8.6-535)に特異的な発光基質(6piOH-2H-CTZ)は、C-2位に官能基がなくC-6位にOH基を持つことが大きい特徴である。 |
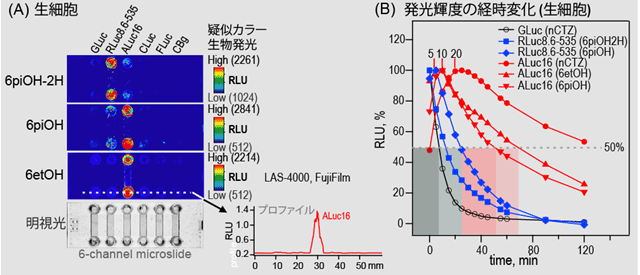
図2の結果は、多数の発光酵素が共存する複雑系において、一つの発光酵素を選択的に発光させることができることを示す。この結果をうけ、さらに動物細胞系においても同様な結果が得られるかどうかを検証する実験を行った。まず、アフリカ緑サル腎臓由来のCOS-7細胞を、6チャンネルマイクロスライドに培養した後、各発光酵素を発現させた。図3で示したように、6種類の異なる発光酵素をそれぞれのチャンネルに発現させた3枚のマイクロスライドを用意した。その後、図2より選択性を示した基質(③、⑮、⑨)を3枚のマイクロスライドにそれぞれ導入した。発光基質③により、人工生物発光酵素(ALuc16)が選択的に発光した。一方、発光基質⑮により、ウミシイタケ発光酵素が選択的に発光した。ところが、発光基質⑨を加えた場合、両方が光ると予測したが、実際には、人工生物発光酵素(ALuc16)の方がより強く発光した。この結果の違いは、細胞溶解系(図2)と生細胞系(図3)が持つ固有の特徴により説明できる。例えば、生細胞系では、細胞膜があるため、細胞膜を透過しやすい発光基質と透過しづらい発光基質があるため、発光輝度に影響する。細胞溶解系では、反応溶液のpHが酸性領域に設定されている。酸性pHは人工生物発光酵素の輝度をより強く抑制することが、以前の研究より既に分かっている。そのため、図2の実験では、結果的に人工生物発光酵素(ALuc16)とウミシイタケ発光酵素の輝度が同様だったと思われる。
 |
|
図3 (A)生きた動物細胞環境下における当該発光基質の発光酵素に選択的な生物発光イメージング。どの発光基質を吹き掛けるかによって特定発光酵素が選択的に光る。(B)前述した生きた動物細胞の生物発光輝度の経過時間による変化。ウミシイタケ生物発光酵素(RLuc8.6-535;細胞質に局在)は早い内に発光輝度を失うが、人工生物発光酵素(ALuc16;細胞小胞体に局在)は、いったん、発光輝度が上がり、それから減衰する(遅れて発光する)。この結果は、細胞質の局在場所の違いによるものと思われる:すなわち、人工生物発光酵素に選択的な発光基質は、2回細胞膜を透過して小胞体内の発光酵素と会うため、上がって下がる発光輝度を示す。本実験に用いた発光酵素の種類:ガウシア生物発光酵素(GLuc); ウミホタル生物発光酵素(RLuc8.6-535); 人工生物発光酵素16(ALuc16); ウミホタル生物発光酵素(CLuc); ホタル生物発光酵素(FLuc); コメツキムシ生物発光酵素グリーン(CBg)。 |
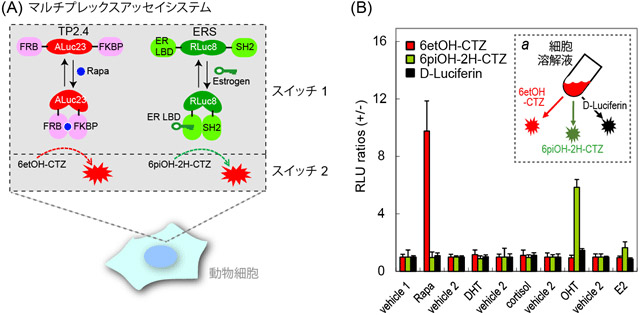
本研究で開発した発光基質が持つ特異的な発光酵素選択性を検証するために、図4ではより複雑なバイオアッセイ系を設計した。まず、当研究グループが以前開発した、2種類の分子ひずみセンサーを、同じ動物細胞に導入して発現させた。それぞれの分子ひずみセンサーは、人工生物発光酵素(ALuc23)とウミシイタケ生物発光酵素(RLuc8)を中身として持っている。このセンサーは(リガンド)と結合すると、センサー分子内タンパク質間の結合が起こるため、その間に挟まれた発光酵素にひずみがかかり発光輝度が増えるように設計されている(Switch 1と称する)。更に、本研究で開発した発光基質を添加することにより、どちらかのセンサーだけを選択的に光らせることができる(Switch 2と称する)。すなわち、スイッチ1が多く共存する複雑系でも、スイッチ2(選択的な基質)により選択的に光を呼ぶことができる。この結果は、同じ発光スペクトルを持つ発光センサーが多く共存する系でも、それぞれの発光信号をピンポイントで光らせることができることを示す。
 |
|
図4 (A)ラパマイシン(免疫毒性物質;Rapa)と女性ホルモン(Estrogen)を同時に測定することのできるアッセイシステム。動物細胞内にラパマイシンを検出する分子ひずみセンサー(TP2.4;人工生物発光酵素(ALuc23)を含有)および女性ホルモン阻害剤(OHT)を検出する分子ひずみセンサー(ERS;ウミシイタケ発光酵素(RLuc8)を含有)を一緒に導入する。多数の化学物質で汚染された廃水(検体)を細胞に振りかけた場合、その化合物が女性ホルモン様活性やラパマイシン様の免疫毒性をもつことがある(スイッチ1)。本システムでは、基質が各センサーに選択性を持つため、センサー相互間のコンタミなくそれぞれの活性を測定することができる。(B)はその結果である。免疫毒性物質(Rapa;赤バー)と女性ホルモン阻害剤(OHT;緑バー)が混ざっている汚染物質に対しても、それぞれ発光コンタミなく活性を測定することができる。略語:Rapa、ラパマイシン; FRB、ラパマイシン結合タンパク質の一つ(mTOR由来); FKBP、ラパマイシン結合タンパク質の一つ; ER LBD、女性ホルモン受容体のリガンド結合ドメイン; SH2、v-SrcのSH2ドメイン; OHT、女性ホルモン抗がん剤。 |
本研究は、生物発光が持つ、発光コンタミという根本的な難題を解決した研究成果である。この成果を用いれば、多数のホルモンや生理活性物質を同時に測定する、小型のバイオアッセイキットを製品化できる。従来技術では、1回に1つの発光信号しか検出できなかったが、本研究の成功により1回に複数の発光信号をコンタミなく測定する高効率バイオアッセイキットが初めて実現可能になった。また患部のマルチカラーイメージングも、多数の発光酵素を用いることにより高効率に実現できるようになった。
今回の成果をベースにさらなる高性能発光基質の合成を行う予定である。例えば、より長波長で発光する発光基質が開発できれば、発光信号の組織透過性が改善される。また、人工生物発光酵素の立体構造を解明することにより、生物発光が持つ発光反応を理解する重要な手がかりになると期待している。
国立研究開発法人 産業技術総合研究所
環境管理研究部門 環境微生物研究グループ
主任研究員 金 誠培 E-mail:kimu-sb*aist.go.jp(*を@に変更して送信下さい。)