国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)生物プロセス研究部門【研究部門長 田村 具博】兼 産総研・東大先端オペランド計測技術オープンイノベーションラボラトリ【ラボ長 雨宮 慶幸】津田 栄 上級主任研究員、同部門 近藤 英昌 主任研究員、西宮 佳志 主任研究員らは、株式会社ニチレイ【代表取締役社長 大谷 邦夫】(以下「ニチレイ」という)技術戦略企画部 小泉 雄史 グループリーダーらと共同で、濃度に応じて分子同士が連結し、氷の結晶成長を止める新しいタイプの不凍タンパク質BpAFPを魚類から発見した。BpAFPを用いることにより、食品や細胞の中に氷の塊を作らせない新たな凍結保存技術を開発できると期待される。
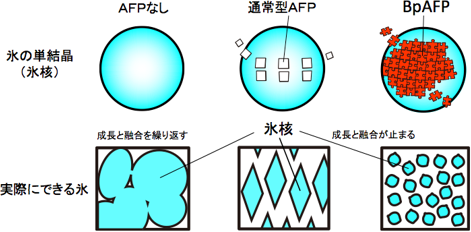
通常の氷は無数の氷核が融合したものであり、それらが時間と共に成長して塊になることが冷凍食品の品質や凍結細胞の生命力を低下させる原因になっている。不凍タンパク質(AFP)には氷核の一部に結合するタイプと全面に結合するタイプがあるが、BpAFPは高濃度になるほど氷核への結合範囲が拡大する新しいタイプの高機能型AFPであることが明らかになった。
なお、この研究の詳細は2017年2月13日に英科学誌サイエンティフィック・リポーツにオンライン掲載された。
 |
|
BpAFPは 水を極めて小さな氷核で埋め尽くして凍らせる |
氷は無数の氷核が密集したものであり、個々の氷核は周囲の水分子を取り込んで成長と融合を繰り返し、氷を大きくする。これは缶飲料を凍結したときに缶が割れることでもよく知られる。もし氷核の成長と融合を止めることができれば、野菜、果実、加工食品、パン類、麺類、清涼飲料、医療品、試薬類、化粧品、顔料、細胞、組織、臓器などを、品質や生命力を損なわずに凍結する新技術ができると考えられてきた。ガラス化保存液と液体窒素凍結保存法にはそうした効果があるが、前者には高い毒性、後者には設備やエネルギーコストの問題があり汎用(はんよう)性が低かった。AFPは0℃よりやや低い温度域でも氷核の成長と融合を抑制できる。特に、氷核の全面に結合できる高機能AFPは高い抑制効果を示す。しかし、既知の高機能型AFPは昆虫などに含まれる極微量成分であり、実用に使える高機能型AFPの開発が強く望まれていた。
産総研ではAFPの高度利用を産業や医学の分野で実現するための研究を進めてきた。魚類を原材料とするAFP大量精製技術や高気孔率セラミックスを製造するためのAFPゲル化凍結技術などを開発する一方、菌類AFPの分子構造解明やAFPの細胞生存率改善効果の発見などの成果もある(関連情報については用語の解説を参照)。AFPの試料が塩や緩衝液の成分を含んでいるとそれら自体が氷や食材、細胞などに悪影響を及ぼすため、そのような不純物を含まない高純度AFPを得るための研究にも力を注いでいた。
なお、今回の研究開発は、日本学術振興会科学研究費助成事業(15K13760)による支援を受けて行った。
通常、タンパク質を水に溶かすときには塩や緩衝液を添加する必要があるがBpAFPは60%(質量パーセント濃度)もの高濃度で純水に溶ける。そこで、蛍光物質を付けたBpAFPの水溶液の中に球状に成形した氷の単結晶(φ=2cm)を入れて取り出し、蛍光を観測した。低濃度の溶液では、図1Aの様に特定の箇所だけが蛍光を発光した。これらの箇所はピラミダル面という氷結晶面であり、BpAFPは低濃度ではこの面だけに結合する一般的なAFPである。しかしBpAFPの濃度を高めてゆくと、全ての氷結晶面が蛍光を発光するように変化した(図1B-D)。これは濃度に応じてBpAFPが全ての氷結晶面への結合を進行させ、高濃度では氷結晶を覆い尽くす特別なAFPとして働くことを示している。この様に、濃度に依存して結合様式を変えるAFPは過去に報告例が無い。次に、BpAFP水溶液を顕微鏡下で凍らせて氷核を調べてみると、BpAFPの濃度が高くなるに連れて先のとがったバイピラミッド型から丸みを帯びたレモン型に変化し、そのサイズも次第に小さくなって行くことが分かった(図1a-d)。また、氷結晶との結合力の指標である熱ヒステリシスの最大値は3.2℃であった。これは、既知AFPと比べても高い値であり、BpAFPが氷核の成長と融合を阻止する能力に優れることを示している。
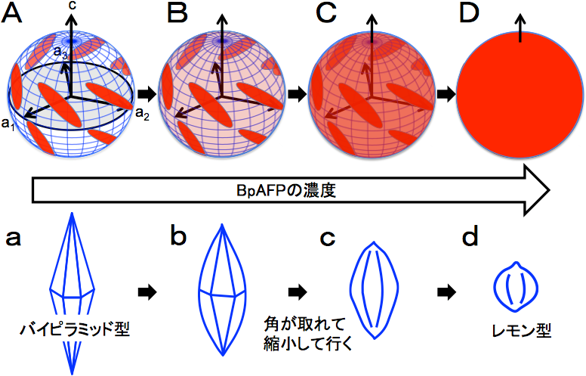 |
図1 BpAFPは濃度に応じて球状の氷核表面への結合を進行させる性質を示した(上)。
BpAFPを含む氷の中の氷核も濃度に応じて変化し小さなレモン型になった(下)。 |
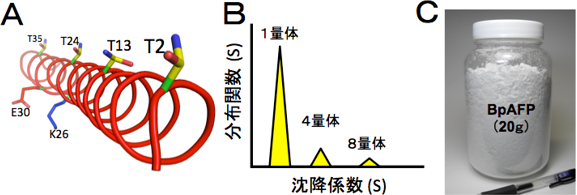
分子構造について解析したところ、BpAFPは連続したアラニンを多く含むアミノ酸配列から成る比較的小さな分子であることがわかった。また、円偏光二色性測定からは、BpAFPが分子表面にスレオニン(T)を等間隔で配置したαらせん型構造を形成することがわかった(図2A)。沈降法の実験からはBpAFPが水溶液中で4量体や8量体を形成することがわかった(図2B)。BpAFPは100℃に加熱後もαらせん構造を維持し、pH 3~8の間で失活しない。これらの結果を総合的に解釈すると、BpAFPは水溶性に優れ、シンプルで安定性の高い分子構造を示し、連結して氷核の全表面を覆い尽くすことにより、氷核の結晶成長と融合を強く抑制すると考えられる。
 |
|
図2 (A)円偏光二色性測定の結果。BpAFPはαらせん型構造を形成し分子表面に等間隔でスレオニン(T)を配置する。(B)沈降法による実験結果。BpAFPは濃度に応じて多量体化し氷核への結合様式を変える。(C)本研究で技術開発した精製度の高いBpAFP。 |
これまで冷凍保存が難しかった食品や細胞などにBpAFPを適用して、それらの品質や生命力に与える効果を明らかにし、特に、ガラス化保存液の成分としてBpAFPを活用する可能性について検討をおこなう。また、ゲル化凍結技術やフリーズドライ技術など、氷核のサイズや形状が関係する他の冷熱利用技術に対するBpAFPの効果についても明らかにする。本研究では、BpAFPを高い精製度で取得する技術も開発することに成功した(図2C)。この高精製度BpAFP試料には水の凍結や細胞の生死に影響をおよぼす塩や緩衝液成分が含まれていないため、希少性の高い試薬や移植用細胞などに対しても応用利用が可能と考えられる。
国立研究開発法人 産業技術総合研究所
生物プロセス研究部門 生体分子工学研究グループ
上級主任研究員 津田 栄 E-mail:s.tsuda*aist.go.jp(*を@に変更して送信下さい。)