国立研究開発法人 産業技術総合研究所【理事長 中鉢 良治】(以下「産総研」という)バイオメディカル研究部門【研究部門長 近江谷 克裕】バイオアナリティカル研究グループ 佐々木 章 研究員と、国立大学法人 北海道大学【総長 山口 佳三】先端生命科学研究院 金城 政孝 教授ら、国立研究開発法人 理化学研究所【理事長 松本 紘】生命システム研究センター 神 隆 チームリーダーは、生きた細胞内に導入したDNAが分解される機構をリアルタイムに可視化する技術を開発し、DNAの分解活性が細胞の種類によって異なっていることを初めて見いだした。
今回、1分子イメージング法に数えられるラスター画像相互相関分光法(ccRICS)の原理を利用し、多数のタイムラプス顕微鏡画像を一括して解析し動画とするプログラムを開発した。この技術によって、生きたままの細胞の中で分解されるDNAを時空間的に可視化することに成功し、外来DNAに対する防御機構として働く、DNAを分解する活性が細胞ごとに異なることを解明した。細胞内のDNA分解機構の解明は、遺伝子治療・核酸医薬の創薬設計に論理的バックボーンを与え、分子メカニズムに基づいた創薬を加速させることが期待される。なお、本成果は、2015年9月24日にScientific Reports誌(電子版、オープンアクセス)に掲載された。
 |
|
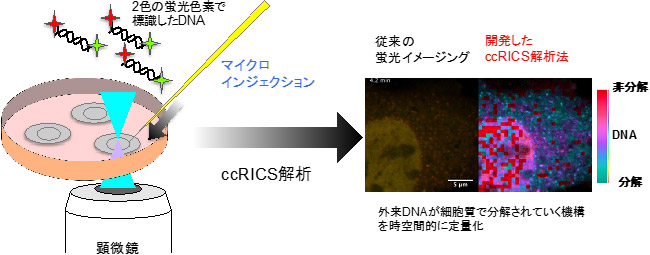
開発したccRICS解析法によるDNA分解可視化の概要 |
最近、遺伝子治療・核酸医薬が注目されてきている。特に任意の遺伝子情報を組み込んだDNAを人工的に細胞内に導入する技術(遺伝子導入)の開発は重要視されている。しかし、外来DNAが細胞内に入ってからの運命はブラックボックスであり、技術開発は試行錯誤を繰り返して行われてきた。
創薬研究を論理的な設計に基づいて進めるには細胞内でのDNAの運命を知ることが不可欠であるが、現状の一般的技術では細胞内で変化するDNAの動態を分子レベルで定量することは十分に達成されていなかった。
産総研は、生体分子や細胞の機能を理解・解明するための新しい創薬基盤技術の開発を推進してきた。生きた細胞の中で非侵襲に1分子レベルの分子事象、例えば遺伝子発現やタンパク質相互作用を定量的に解釈できる技術の開発は難易度が高いものであるが、今回北海道大学と共同で最先端の顕微鏡技術であるラスター画像相互相関分光法(Raster image cross-correlation spectroscopy; ccRICS)を利用した細胞内DNA分解の定量化方法を開発した結果、今回の成果につながった。
なお、本研究開発は、独立行政法人 日本学術振興会 科研費 若手研究Bによる支援を受けて行ったものである。
今回の技術は生きた細胞の中でダイナミックに進行する生命現象である「外来DNAの分解」を時空間的に可視化する方法を考案し、分解されたDNAの割合と分解速度を動画で観察可能な解析手法の開発に至った。細胞内への遺伝子導入は遺伝子治療や核酸医薬の根幹をなす基盤技術である。導入されたDNAは機能を保った状態で機能現場に到達することが必要であるが、細胞による外来のDNAに対する防御機構によって分解されると考えられている。
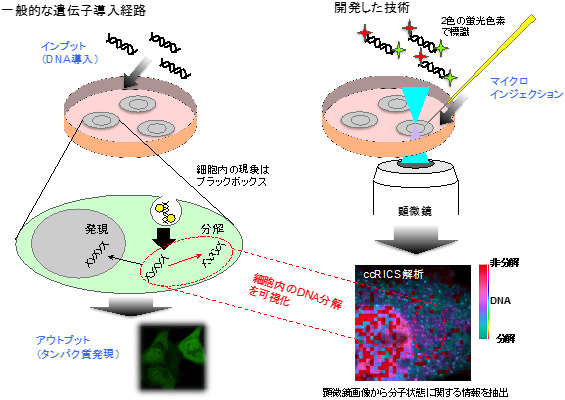
図1に一般的な遺伝子導入の機序と今回注目した細胞質における分解について示す。
 |
|
図1 遺伝子導入の機序と開発した技術概要 |
|
DNAが分解されたかどうか判別するために、導入する外来DNA(30 塩基対)を2色の蛍光色素で標識した。ccRICSは、分子の運動を観測しこの2色の蛍光シグナルが同時に変動するか、別々に変動するかを解析することで2色の蛍光色素の分離、すなわちDNAの分解を検出することができる。さらに、多数のタイムラプス画像を一括して処理するプログラムを開発することで検出したDNAの分解を動画にすることを可能にした。本研究では研究対象としてMEF細胞とHEK293細胞を使用した。MEF細胞は遺伝子導入の効率が悪く、HEK293は遺伝子導入によるタンパク質発現が容易な細胞として知られている。それらの効率の差には、細胞内のDNA分解活性が関与しているという仮説を立てた。 |
 |
|
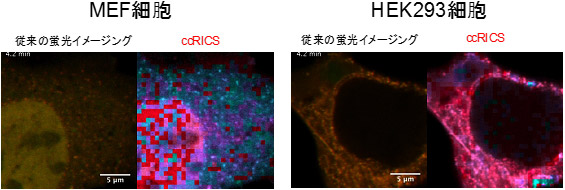
図2 生きた細胞内におけるDNA分解活性の観察 (導入から4.2分後) |
作製した蛍光標識DNAをMEF細胞とHEK293細胞にマイクロインジェクションしccRICSでDNAの分解を可視化した(図2)。
その結果、MEF細胞ではDNAが細胞質において5分以内に分解を受けており、一方でHEK293では顕著な分解は見られなかった。これは見いだした細胞内でのDNA分解活性が外来遺伝子発現効率と負の相関を持つという仮説を支持することに加え、細胞の種類によって細胞質内のDNA分解活性が異なるという新しい概念の発見である。また、遺伝子導入に用いる(遺伝情報をコードした)DNAは今回のモデルDNAよりも大きく移動速度が遅いため、細胞質での滞留時間が長くなる(~数時間)。したがって、このような分解を制御することは外来遺伝子発現効率の向上につながる可能性がある。
今後応用に結びつけていくために、今回発見した分解メカニズムがどの分子によって担われるかを明らかにしていく予定である。そこで次世代シーケンサー技術等を組み合わせつつ研究を進める。将来的には、遺伝子治療・核酸医薬のみならず、DNA代謝と疾患の関係等幅広く本技術を展開することを目指す。
国立研究開発法人 産業技術総合研究所
バイオメディカル研究部門 バイオアナリティカル研究グループ
研究員 佐々木 章 E-mail:akira.sasaki*aist.go.jp(*を@に変更して送信下さい。)