独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)バイオメディカル研究部門【研究部門長 織田 雅直】シグナル分子研究グループ 今村 亨 研究グループ長、鈴木 理 主任研究員は、愛知医科大学の分析支援を得て細胞表面などに存在する
糖鎖である
硫酸化グリコサミノグリカンがホルモン
FGF19の作用を規定する重要な役割を果たしていることを明らかにした。
FGF19は胆汁酸やグリコーゲンの合成を調節するホルモンである。食後、胆汁の刺激により腸管で産生され、血流にのって肝臓に到達し、肝臓における胆汁酸の合成を抑制したり、グリコーゲンとして糖を貯蔵する肝臓機能を調節したりする。しかしこれまで、生理的濃度のFGF19に対する細胞の応答は検出できず、その仕組みは不明だった。本研究ではこの濃度で特異的活性を発揮するためにはFGF受容体4と補助受容体β-クロトーだけでなく、硫酸化グリコサミノグリカンが必要であることを初めて示した。これらの成果により、FGF19ホルモンの異常による、下痢や便秘などの消化器疾病や、ある種の糖尿病などの代謝疾患の治療に向けた創薬への展開が期待される。
本成果の詳細は、米国生化学分子生物学会誌Journal of Biological Chemistry 2011年7月29日号に掲載される。(電子版に6月8日に掲載された。)
 |
|
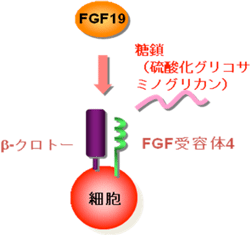
図 ホルモンFGF19の細胞応答の概略
|
FGF19は、ヒトの体内で合成されるホルモン(内分泌因子)である。そして人体最大の化学工場と呼ばれる肝臓における胆汁酸やグリコーゲン合成の調節など代謝を調節する重要な因子である。代謝に関わるさまざまな疾病によって肝臓に異常を来した場合に、肝臓機能を改善・補填する技術が治療に有用である。このため、FGF19の活性を利用することを目指した研究開発が活発に行われているが、これまでは生理的濃度のFGF19では活性が検出できず、多くの研究では生理的濃度の数百倍(10 nM程度)以上の濃度のFGF19が用いられてきた。そこで、ヒトの血液中濃度(0.03 nM~0.1 nM程度)での活性の検出と、これを可能にするための必要条件の解明が求められていた。
-
研究の経緯
-
産総研では細胞や個体の働きを制御するシグナル分子の機能を明らかにし、それらの知見をもとに新たな機能分子の創製や創薬のターゲット分子の同定を行っている。これまでにシグナル分子の一種であるFGF21が血糖低下作用などの活性を発揮する際に受容体に加えて必要な補助受容体β-クロトーを同定し、FGF21の近縁分子であるFGF19の作用にもβ-クロトーが関わることを明らかにしてきた(Molecular Endocrinology 22, 1006-1014, 2008)。
FGF19は、
繊維芽細胞増殖因子(fibroblast growth factor; FGF)ファミリーという分子群に属するホルモンである。FGFの活性は、標的となる細胞表面のFGF受容体を介して細胞内に伝達されるが、通常研究に使用される培養細胞は、もともと複数種のFGF受容体やグリコサミノグリカン糖鎖をもつため精密な解析が困難であった。本研究では、FGF受容体やグリコサミノグリカン糖鎖を持たない細胞株を利用し、これに解析すべきヒトFGF受容体やヒト補助受容体を発現させたり、糖鎖を加えたりすることで、細胞反応に必要な分子を決定した。
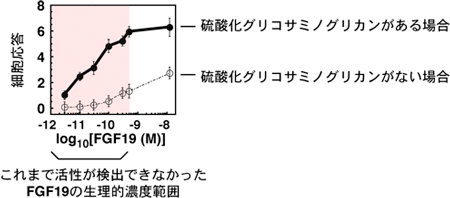
この新規測定系を用いて調べたところ、補助受容体β-クロトーと共にFGF受容体4が存在している細胞に対して、生理的な濃度のFGF19は、細胞応答をほとんど引き起こさなかった。これに対し、図1に示すように、FGF19の標的器官である肝臓の成分である硫酸化グリコサミノグリカンなどの糖鎖を測定系に共存させると、強い細胞応答を引き起こすことが分かった。
 |
|
図1 FGF19濃度と細胞応答の関係
|
なお、FGF受容体4以外のFGF受容体と補助受容体β-クロトーの組み合わせでは、硫酸化グリコサミノグリカンによる細胞応答の増強作用は認められず、硫酸化グリコサミノグリカンがFGF19の標的の選択と感度の両方をコントロールしていることが明らかとなった。
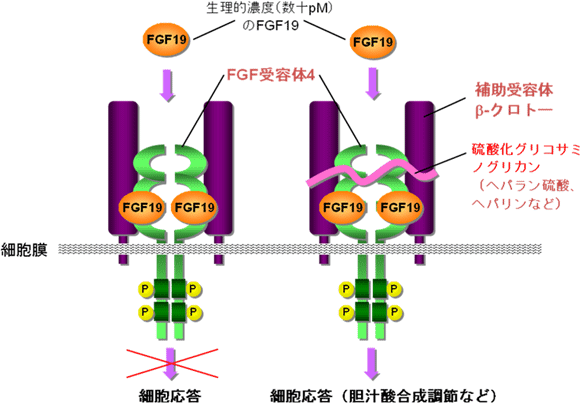
これらの結果から、図2に示すように、生理的濃度のFGF19が細胞応答を引き起こすためには、硫酸化グリコサミノグリカン・FGF19・FGF受容体4・補助受容体β-クロトーの複合体形成が必要であるという新たな分子機構のモデルを考えた。
 |
|
図2 今回の発見をもとにしたFGF19認識機構のモデル
|
胆汁酸下痢や慢性特発性便秘症などの疾病では、FGF19フィードバック異常による胆汁酸合成調節の不全などが示唆されている。さらにFGF19は、食後にブドウ糖をグリコーゲンとして肝臓に貯蔵する活性が示唆されている。これらの細胞応答に係る分子が今回のモデルで明らかになったと言える。このモデルの利用法の一つとして、細胞アッセイ系を構築してスクリーニングに用いることにより、下痢、便秘、糖尿病など疾病の予防や治療に用いる創薬に貢献することが期待できる。また別の利用法として、患者において、モデルに関与する分子に関連する遺伝子やその発現を、病態と合わせて解析することで、疾病の診断・予防・治療に役立てることも期待できる。
今後、どのような硫酸化グリコサミノグリカンの構造が認識されるのかなどをより詳細に解析するとともに、硫酸化グリコサミノグリカン・FGF19・FGF受容体・補助受容体β-クロトーの複合体形成における分子間相互作用部位などを明らかにすることにより、FGF19認識機構のモデルの妥当性を検証したい。
独立行政法人 産業技術総合研究所
バイオメディカル研究部門 シグナル分子研究グループ
研究グループ長/主幹研究員 今村 亨 E-mail:imamura-toru*aist.go.jp(*を@に変更して送信下さい。)
バイオメディカル研究部門 シグナル分子研究グループ
主任研究員 鈴木 理 E-mail:suzuki-m*aist.go.jp(*を@に変更して送信下さい。)