独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)糖鎖医工学研究センター【研究センター長 成松 久】平林 淳 副研究センター長とレクチン応用開発チーム【研究チーム長 平林 淳】舘野 浩章 研究員は、
糖鎖プロファイリング技術により、初期化遺伝子の導入によって
iPS細胞が作製される際に全遺伝子の発現パターンが「
リプログラミング」されるだけでなく、iPS細胞表面の糖鎖構造も同時に「リプログラミング」されることを発見した。
糖鎖は発生段階や環境の変化によって鋭敏に変化するため、iPS細胞など幹細胞の未分化性の維持と糖鎖構造には関係があると予想される。そこで、起源の異なる親細胞から作製されたiPS細胞を、レクチンマイクロアレイを用いた糖鎖プロファイリング技術で調べた結果、iPS細胞とES細胞には共通した新規糖鎖マーカーがあること、iPS細胞表面の糖鎖構造が「リプログラミング」されること、iPS細胞を作製する際に用いるマウス由来のフィーダー細胞の混入を検出できるレクチンがあることを発見した。これらは、糖鎖プロファイリング技術による各種幹細胞の品質、安全評価が可能であり、再生医療などの実用化に寄与できると期待される。
本成果の詳細は、米国生化学分子生物学会誌Journal of Biological Chemistry 2011年6月号に掲載される(4月6日に電子版に掲載された)。
 |
|
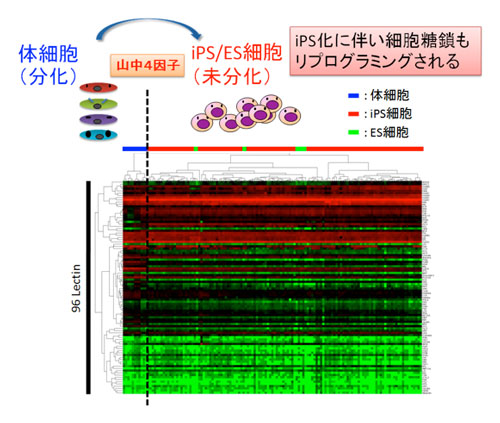
図1 各種細胞の糖鎖プロファイル(クラスター解析)
|
|
起源の異なる体細胞(青)は、組織ごとに異なるプロファイルを持つが、これらの体細胞から作製したiPS細胞(赤)やES細胞(緑)は、ほぼ同じ糖鎖構造のプロファイル(図ではそれぞれ縦長の縞模様で表示)を示す。
|
iPS細胞はヒトの受精卵を材料として調製されるES細胞と異なり、皮膚や血液などから得られる自己の体細胞から調製できる多能性の幹細胞であるため、再生医療や創薬開発への期待が高い。しかし、一般にiPS細胞を調製する際にはがん遺伝子を用いることが多いことから、がん化の問題が不可避となっている。一方、糖鎖は「細胞の顔」とされ、発生段階でその構造が著しく変化することが古くから知られており、がん化との関連も深い。このため、遺伝子のリプログラミングに際し、糖鎖全体の構造がどのように変化し、そのことが未分化性とどのような関係があるのか、について専門家の間ではしばしば話題となっていた。しかし、それを解析するための具体的手法が無く、iPS細胞を含む幹細胞の糖鎖解析は今までなされたことがほとんど無かった。もし、iPS細胞をはじめとする幹細胞の評価に、簡便な糖鎖評価の新技術が活用できるなら、安全性や有効性を判断する新たな評価軸となり、幹細胞の実用化に貢献することが期待される。
糖鎖は、枝分かれ構造や立体異性の違いに基づく複雑な構造を持ち、糖鎖構造の合成制御は細胞の種類や状態(発生段階やがん化など)と密接に関係している。そのため、解析手法も複雑で、時間のかかるものであった。これまで産総研では、糖鎖遺伝子、糖鎖合成ロボット、糖鎖微量迅速解析システムなどの新しい分析手法を確立してきた。それらの構造解析の一環として、糖鎖に結合しやすいタンパク質(レクチン)を多種類用意し、これらと糖鎖との結合を一組のデータセットとして相互比較する糖鎖プロファイリング技術の研究を進め、高精度なプロファイリングが可能なシステムを開発した。(
2005年11月18日産総研プレス発表)
今回の研究成果は、独立行政法人 新エネルギー・産業技術総合開発機構の「iPS細胞等幹細胞産業応用促進基盤技術開発プロジェクト」の一環として得られたものである。
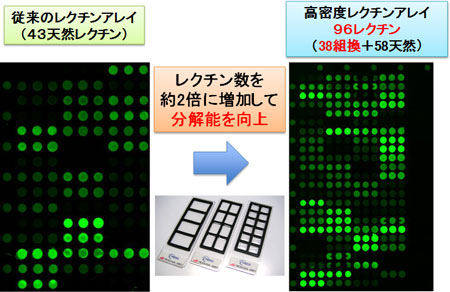
今回、レクチンマイクロアレイの性能を上げるためにレクチンの数を増やし、組換え体を含む96種のレクチンをスライドガラスに固定化した「高密度レクチンマイクロアレイ」を開発した(図2)。体細胞に4つの初期化遺伝子(Oct4、Sox2、 c-Myc、 Klf4)を導入すると、遺伝子発現のリプログラミングが起こり、未分化性と無限増殖性を備えたiPS細胞が作られるが、このときの細胞上の糖鎖の変化を今回開発したレクチンマイクロアレイを用いて糖鎖プロファイルの比較解析を行ったところ、細胞上の糖鎖もリプログラミングされることがわかった(図1)。
国立成育医療センターの協力により、4つの異なる組織(羊膜、子宮内膜、胎児肺、胎盤動脈)から114種のiPS細胞を作製し、糖鎖プロファイルを測定した。元の体細胞が組織ごとに異なる糖鎖プロファイルを持っていたにもかかわらず、作製されたiPS細胞は、いずれもほぼ同じ糖鎖プロファイルを示し、初期化遺伝子の導入により一様な糖鎖構造が作られることがわかった。これは、糖鎖合成に関わる遺伝子の発現解析からも裏付けられた。さらに、iPS細胞の糖鎖プロファイルは、もう1つの多能性幹細胞である受精卵由来のES細胞ともほぼ一致していた。このことは、糖鎖構造が幹細胞の未分化性と関連していることを示しているが、糖鎖構造の変化が未分化という状態になった「結果」であるのか、あるいは糖鎖が未分化性を積極的に維持するような何らかの「原因」であるのか、という2つの可能性が考えられる。
 |
|
図2 今回開発した高密度レクチンマイクロアレイ
|
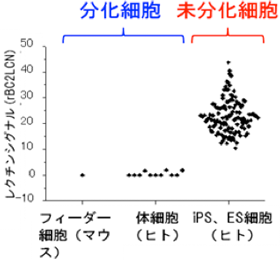
今回の研究により、すべての未分化細胞(iPS細胞114種とES細胞9種)と反応し、かつ元の4つの体細胞(羊膜、子宮内膜、胎児肺、胎盤動脈由来)とは全く反応しないレクチンを1種類発見した(図3)。rBC2LCNと名付けたこのレクチンは、これまで知られるプローブ(主として細胞表面分子に対する抗体)とは異なる分子を認識している可能性があり、未分化細胞を特定する新たなプローブ分子の発見が期待される。
さらに、iPS細胞を作製する際にマウス由来のフィーダー細胞を用いるが、その細胞の混入を検出できるレクチンも発見した。rMOAと名付けられたこのレクチンは、αGal抗原として知られる糖鎖構造に特異的に結合するが、ヒト由来の細胞ではαGal抗原が合成されないので、マウスのフィーダー細胞が混入していると、このレクチンの結合シグナルが陽性となり、混入が検出できる。
 |
|
図3 新規糖鎖プローブrBC2LCNの各種細胞との反応結果
|
|
rBC2LCNはすべての未分化細胞と反応したが(感度100%)、分化した体細胞には全く反応しなかった(特異度100%)
|
幹細胞を評価する手法は、これまで遺伝子発現や表面マーカーの検出など、海外発の技術によるものが多く、しかもいずれも手間のかかる手法であった。今回開発したレクチンマイクロアレイによる細胞評価法はわが国が世界に先駆けて実用化した独自技術であり、今後、幹細胞評価の一環として安全性や分化指向性の解析のほか、糖タンパク質などのバイオ医薬品開発、有用微生物の品質管理など、多様な産業応用が期待される。
未分化細胞と反応するrBC2LCNというレクチンが認識結合する糖鎖構造はレクチンの特異性解析からある程度構造は推定できるが、今後詳細な構造解析を行う。
また、rBC2LCNを活用した新規未分化マーカーの実効性を広く検証し、iPS細胞の産業実用化をさらに加速させていくため、国内外の関連研究機関との連携強化を図っていく予定である。
独立行政法人 産業技術総合研究所
糖鎖医工学研究センター レクチン応用開発チーム
研究員 舘野 浩章 E-mail:h-tateno*aist.go.jp(*を@に変更して送信下さい。)
糖鎖医工学研究センター
副研究センター長 平林 淳 E-mail:jun-hirabayashi*aist.go.jp(*を@に変更して送信下さい。)