独立行政法人 産業技術総合研究所【理事長 野間口 有】(以下「産総研」という)糖鎖医工学研究センター【研究センター長 成松 久】 糖鎖遺伝子機能解析チーム 【研究チーム長 成松 久】成松 由規 産総研特別研究員、久保田 智巳 研究員ら、バイオメディカル研究部門 【研究部門長 織田 雅直】 分子複合医薬研究グループ 【研究グループ長 宮岸 真】 山崎 和彦 主任研究員、健康維持機能物質開発研究グループ 【研究グループ長 丸山 進】森井 尚之 主任研究員は、抗体の一種であるIgA1に結合しているO結合型糖鎖が抗体の構造に大きな影響を及ぼしていることをNMR解析により発見した。
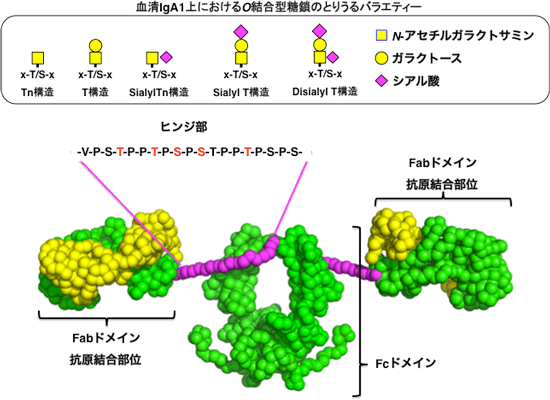
IgA1には、分子内のFabドメインとFcドメインをつなぐヒンジ部に抗体としては珍しいムチン型O結合型糖鎖が結合している(図1)。今回、そのヒンジ部について安定同位体で標識した19残基のポリペプチド鎖(ヒンジペプチド)を化学合成し、さらに糖鎖を糖転移酵素により付加、NMR法により構造解析した。その結果、糖鎖付加によりヒンジ部のプロリン残基のシス/トランス異性化の動的な平衡がトランス型へ顕著に傾き、分子全体として、より均一化した構造になることがわかった。
IgA1は、抗体の一種であるが、同時に、IgA腎症という疾患においては腎糸球体に沈着する主な分子で、ヒンジ部の糖鎖の異常とIgA腎症の関連が示唆されている。その前提に立てば、本研究の「糖鎖と構造」の解析がIgA腎症におけるIgA沈着のメカニズム解明につながることが期待される。
本成果の詳細は、米国化学会誌Journal of American Chemical Society 2010年4月28日号(J. Am. Chem. Soc. 132(16), 5548-9 (2010))において発表された。
 |
|
図1: 抗体IgA1の分子構造。ヒンジ部の5カ所 (赤)にO結合型糖鎖が結合する。
|
現在、我が国における透析患者数は28万人を超えて年々増加の一途をたどっている。そのうちIgA腎症が原因である透析患者数は4~5万人と非常に多いが、発症や進展のメカニズムが不明であり、治療法が確立されていない。IgA腎症は、ヒトの抗体の一種であるIgA1分子の腎糸球体沈着を特徴とした慢性糸球体腎炎である。患者の約40%が20年以内に腎不全に移行することから、極めて予後不良な疾患として難治性疾患克服研究事業の対象に指定されている。
IgA1は、一つのFcドメインと二つのFabドメインがヒンジ部によって結ばれた構造をしている。通常、血液中のIgA1ではヒンジ部のうち特定の5カ所にO結合型糖鎖という糖鎖が結合している(図1)。IgA腎症患者のIgA1には不完全な構造の糖鎖が含まれていることが示唆されているが、ヒンジ部のO結合型糖鎖について、どのアミノ酸残基のどの糖鎖がどのように変化しているかという詳細な差異については、現在の技術では解析できない。結果として腎症と糖鎖異常との間の相関は見いだされていない。さらにそれら糖鎖異常のIgA1分子が本当に原因分子であるか、糖鎖の異常によってIgA1分子構造にどのような変化が生じているのか、そしてどうして沈着に至るのかといった詳しいメカニズムについてはほとんどわかっていない。
産総研では、独立行政法人 新エネルギー・産業技術総合開発機構(NEDO)からの受託事業として2001年度より、バイオテクノロジー開発技術研究組合と共同で糖鎖研究を継続して実施している。2006年度より開始した「糖鎖機能活用技術開発」プロジェクトにおいて、疾患と関連のある糖鎖機能の研究開発を実施している。また、先端機器共用イノベーションプラットフォーム(http://www.open-innovation.jp/ibec/)で外部公開も行っている高分解能NMR施設を利用して、タンパク質や核酸など生体高分子の立体構造解析を行ってきている。
これらの蓄積をもとに、産総研ではIgA1分子の構造と性質、挙動を理解することがIgA腎症の発症メカニズム、特にIgA1分子の腎糸球体沈着の解明につながることに期待し、本研究を実施した。
IgA1分子のヒンジ部に結合した糖鎖の数や構造の変化によってヒンジ部のペプチド鎖の構造が変化し、IgA1分子全体の構造や性質に影響を与える可能性があると考え、ヒンジ部の19個のアミノ酸残基について、糖鎖が結合することによってヒンジ部のペプチド鎖の構造にどのような影響が現れるかをNMR法により解析した。
特に立体構造に大きく寄与すると考えられるプロリン残基のシス型とトランス型の異性化平衡に着目し、特定のプロリン残基を安定同位体13Cで標識したペプチドを合成し、NMR法によってそのシス型とトランス型に起因する信号(共鳴シグナル)をそれぞれ区別して測定した。この合成ヒンジペプチドに糖転移酵素を用いてO結合型糖鎖の最初の糖であるN-アセチルガラクトサミン(GalNAc)を結合させると、動的な異性化平衡が変化し、シス型プロリン残基の比率が顕著に減少した。特に、糖鎖が付加された残基のカルボキシル末端側に隣接するプロリン残基の場合、シス型プロリン残基の比率が1/6程度まで減少した。
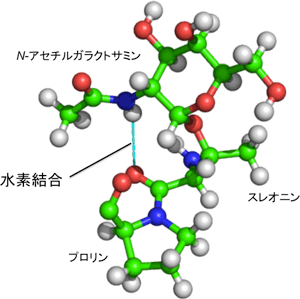
シス型とトランス型の割合の温度依存性を用いた熱力学解析を行った結果、トランス型においてのみ糖鎖とペプチド鎖の間で水素結合が形成されると考えられた。実際に、トランス型の立体構造解析を行ったところ、GalNAcのアミド基とペプチド鎖の間に水素結合が形成されて、それらの相対位置が固定されることがわかった(図2)。
 |
|
図2: 糖とペプチド鎖の間の水素結合
|
糖鎖がヒンジ部に結合することによって、1) シス型プロリン残基が顕著に減少してトランス型プロリン残基だけを含むヒンジ部の割合が増すこと、さらに、2) トランス型では、糖鎖とタンパク質の間の水素結合が形成され相対位置が固定されること、という二つの効果により、ヒンジ部の分子構造が均一化する。この結果として、IgA1分子のヒンジ部がつなぐ二つのドメインの相対位置も均一化する。すなわち、ヒンジ部のO結合型糖鎖には、IgA1分子がとりうる構造を、より均一化する効果があることが明らかになった。図3に示すように、ヒンジ部のプロリン残基が全てトランス型(オールトランス型)となっているIgA1分子(色付)は横長のT字型と考えられる。ヒンジ部にシス型プロリン残基を含む分子のFabはオールトランス型のものと全く異なる位置に来ると予想される(無色)。ヒンジ部にO結合型糖鎖が結合する(赤丸)ことにより、オールトランス型のヒンジ部の割合が60%から90%に増加し、分子構造の均一性が高まる。
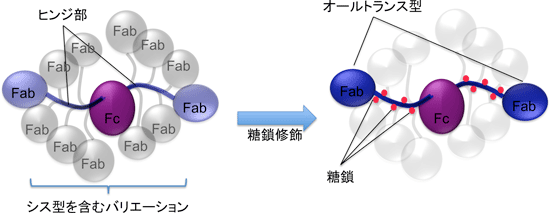 |
図3: ヒンジ部構造の均一化によるIgA分子構造の均一化
|
本研究から、糖鎖の付加がペプチド構造に大きく影響を与えることが認められ、それによってIgA分子全体の構造に影響することが示唆された。IgA腎症とIgA1中のO結合型糖鎖の構造変化が関連するという可能性を支持するならば、患者の血清中には糖鎖の構造変化によって、性質や構造が変化したIgA1分子が存在すると予想され、そのような構造的変化をともなったIgA1分子がIgA腎症、特に腎糸球体への沈着に関与するかもしれない。
今後、糖鎖をより伸長あるいは改変したときの立体構造の変化をNMR法により解析する。さらにヒンジ部のO結合型糖鎖の不完全性が引き起こす構造や性質の変化について、IgA分子全体を観察する方法での解析を行っていく。IgA1分子の挙動をより詳細に解析することでIgA腎症の発症メカニズムの糸口をつかみたい。
独立行政法人 産業技術総合研究所
バイオメディカル研究部門 分子複合医薬研究グループ
主任研究員 山崎 和彦 E-mail:k-yamasaki*aist.go.jp(*を@に変更して送信下さい。)
独立行政法人 産業技術総合研究所
糖鎖医工学研究センター 糖鎖遺伝子機能解析チーム
研究員 久保田 智巳 E-mail:tom.kubota*aist.go.jp(*を@に変更して送信下さい。)