独立行政法人産業技術総合研究所【理事長 野間口 有】 健康工学研究センター【研究センター長 国分 友邦】・生体ナノ計測チーム【研究チーム長 石川 満】のヴァスデヴァンピライ ビジュ(Biju Vasudevan Pillai)研究員、石川 満 研究チーム長らは、動物およびヒトの培養細胞を用いて、ペプチド被覆したナノ粒子がクラスリンと呼ばれるタンパク質の形成するポケットに入って細胞に取り込まれることを可視化し、その機構を定量的に評価することに成功した。
この発見のカギは、蛍光による可視化が可能な半導体ナノ粒子である量子ドットを用いたことである。量子ドットの表面をアラトスタチン(AST1)という昆虫由来のペプチドで被覆した。ナノ粒子が細胞に取り込まれる機構としては、受容体経由でクラスリンポケットの関与する機構と、クラスリンの関与しない機構が併存していることが知られていたが、今回、初めて両機構の割合を定量的に評価し、クラスリンの関与する機構がおおよそ2:1で支配的であることを実証した。
この成果は米国化学会発行のACS Nano誌(オンライン掲載、2009年8月4日)に掲載された(ACS Nano 3,2419-2429, 2009)。
生体親和性を付与したナノ材料は再生医療材料や種々の疾病を検出・可視化するために有用である。その観点から、直径が数ナノから数十ナノメートル(nm)の半導体の球形結晶である量子ドットは蛍光性であるので、種々のバイオメディカルの現場において、従来の有機蛍光色素に比べて高感度かつ耐久性の高い可視化プローブとして注目されている。従来の有機蛍光色素は、蛍光に必要な外部照射光によって観測中に光退色して観測できなくなるという欠点があった。
また、ドラッグデリバリーへの応用が注目されており、ナノ粒子表面にDNA、タンパク質、ペプチドなどを結合させることが検討されている。しかし、ペプチド結合ナノ粒子がどのようにして生きた細胞中、さらには細胞核にまで到達するのか未知であった。
健康工学研究センター生体ナノ計測チームでは、生体ナノ計測を通じた健康工学への寄与という視点からナノ粒子に注目して、その細胞機能および疾病の指標となるバイオマーカーの可視化への応用に向けて研究している。
有機色素を用いて細胞表面、細胞質内部の構造、および核を標識することは医療における細胞検査や生化学実験においてよくおこなわれている。一方、量子ドットは細胞質内部に取り込ませること自体が困難である。しばしば細胞膜の内側で凝集するので、細胞質内部さらに核内に到達させた例は知られていない。当研究チームは、量子ドットをアラトスタチン(AST1)と呼ばれる昆虫由来のペプチドで被覆すると、凝集せずに細胞質のみならず核内にまで(図1)、効率よく運搬されることを見出した(V. Biju et al. Langmuir 2007, 23, 10254)。
今回、量子ドットが細胞質内部に取り込まれる初期過程の分子機構を解明するために、ペプチド受容体と細胞膜上の“くぼみ”を構成するタンパク質クラスリンに注目して研究をおこなった。
 |
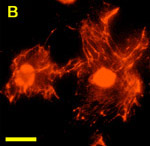 |
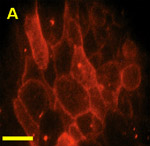
図1 ナノ粒子量子ドットを取り込んだ細胞の蛍光画像
(A)ペプチドで被覆しない量子ドットを取り込んだ細胞:量子ドットは細胞膜近傍に局在し、細胞内部には取り込まれない(ヒト扁平上皮がん細胞A431)。
(B)ペプチドAST1で被覆した量子ドットを取り込んだ細胞:細胞質内部および核にまで量子ドットが取り込まれている(マウス線維芽細胞3T3)。
|
|
30µm
|
10µm
|
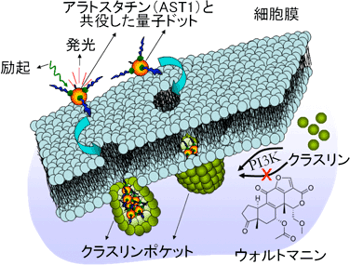
細胞が物質を取り込むエンドサイトーシスの代表的な機構として、受容体タンパク質の関与する機構がある。その機構によると外来のタンパク質やペプチド(ホルモン等)、あるいはウイルス等のナノ粒子は、細胞膜上でそれらを認識する受容体タンパク質と結合し、受容体の構造は変化する。一方、細胞膜上には“くぼみ”があって、これはクラスリンというタンパク質がいくつか集まって形成されており、クラスリンポケットと呼ばれている。ナノ粒子と結合した受容体タンパク質はクラスリンポケットと出会うと、クラスリンポケットにナノ粒子が補足される。(受容体とくぼみの出会いは、細胞膜表面における拡散過程で確率的に支配されている。)ナノ粒子を捕捉したクラスリンポケットは袋状(小胞)となって細胞膜からちぎれて細胞質内へ移動し、エンドサイトーシスが開始する(図2)。
 |
|
図2 タンパク質クラスリンが関与するエンドサイトーシスの初期過程を示す模式図。ただし、受容体は図に含まれていない。クラスリンはいくつか集まってクラスリンポケットを形成する。薬剤ウォルトマニンは酵素PI3Kを阻害してクラスリンポケットの形成を阻害する。
|
もうひとつの機構として、ペプチドを構成するアミノ酸が有する正電荷の効果により細胞膜を透過する過程が支配的なエンドサイトーシス機構が提唱されている。この場合、受容体およびクラスリンは関与しない。
クラスリンの関与するエンドサイトーシスと、関与しない機構の割合を定量的に評価するための実験をおこなった。
実験で使用した細胞はマウス線維芽細胞3T3およびヒト扁平上皮がん細胞A431である。ナノ粒子としては、アラトスタチン(AST1)という昆虫由来のペプチドで量子ドットの表面を被覆したナノ粒子QD-AST1を用いた。ナノ粒子を細胞に取り込ませる実験では、104~105個の細胞を用いて、QD-AST1の蛍光強度をフローサイトメトリーにより測定し、ナノ粒子が細胞に取り込まれる数を評価した。
ペプチドAST1の昆虫における本来の受容体が、動物細胞膜に存在するガラニン受容体に似ていることから、ガラニン受容体が動物細胞においてエンドサイトーシスの初期過程に関与していると予想した。そこでガラニン受容体の活性を阻害する薬剤を用いてガラニン受容体の活性を阻害したところ、意外なことにQD-AST1の細胞への取り込み阻害は10%以下であり、阻害をほとんど受けなかったと言って良い。このことはガラニン受容体以外の未知の受容体が関与していることを示唆している。
次に、正電荷の効果により細胞膜を透過する過程の割合を評価するための実験を行った。ペプチドAST1を構成するアミノ酸の正電荷を除くために、正電荷アミノ酸アルギニンを無電荷のアミノ酸アラニンに置換したAST1の変異体を用い、さらに細胞膜表面に存在する糖タンパク質に由来する負電荷を酵素処理してとり除いた。その結果、ナノ粒子の細胞への取り込み阻害は30%以下であり、ペプチドの正電荷による過程も30%程度存在することが示唆された。
最後にクラスリンポケットの形成に関与する酵素を阻害した。クラスリンポケットの形成には、PI3Kという酵素が関与している。この酵素を選択的に阻害する抗がん剤として知られる薬剤ウォルトマニンを用いて細胞を処理して(図2)、未処理の細胞と比較してクラスリン機構が関与する程度を評価した。図3はQD-AST1を取り込ませたA431細胞について、PI3K酵素を阻害しない場合(3A)と阻害した場合(3B)の蛍光強度のヒストグラムである。図3Bでは蛍光強度のピークは左側にシフトしており(3Aの150から3Bの50)蛍光強度が顕著に減少していることがわかる。蛍光強度×細胞数の面積から、取り込みの阻害率は約57%と計算された。
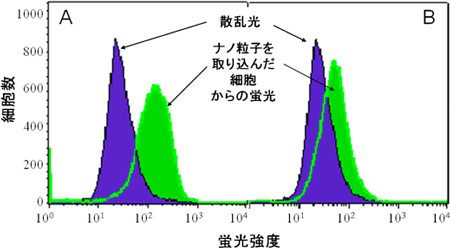 |
図3ナノ粒子QD-AST1がヒト扁平上皮がん細胞A431に取り込まれた数をフローサイトメトリーで測定
(A)クラスリンポケットの形成阻害なし:細胞数最大の蛍光強度は150。ナノ粒子QD-AST1が細胞に取り込まれている。
(B)薬剤によりクラスリンポケットの形成を阻害した細胞:細胞数最大の蛍光強度は50。ナノ粒子QD-AST1の細胞への取り込みは減少した。蛍光強度×細胞数の面積から、取り込み阻害率は約57%と計算された。
|
この結果は、PIK3酵素が関与するクラスリンポケット形成がQD-AST1の細胞内取り込みに大きく寄与していることを示している。さらに、QD-AST1を取り込んだ細胞を、異なる色の蛍光色素で標識したクラスリン抗体で処理してクラスリンを可視化したところ、QD-AST1とクラスリンそれぞれの蛍光が細胞内部で重なっていることが確かめられた。これはQD-AST1とクラスリンが細胞内部で共存していることを示している。この結果は細胞内でクラスリンポケットから形成された小胞によってナノ粒子が運ばれていることを支持し、クラスリン機構が支配的なことを示している。
以上の結果を要約すれば、ナノ粒子QD-AST1のエンドサイトーシスには、受容体経由クラスリンポケットの関与する機構とクラスリンの関与しない機構が併存しており、クラスリンの関与する機構がおおよそ2:1で支配的であることを定量的に実証した。
昆虫や、他の天然由来のペプチドは容易に入手できるので、量子ドットなどのナノ粒子とペプチドとの結合体が、生体親和ナノ材料のひとつとして有用となることが期待される。今後は、量子ドットを含むナノ粒子とペプチドなどの生体分子の新しい結合体の開発とその応用を展開したい。この際、生体分子としてはペプチドだけでなく、DNA、RNA、そしてタンパク質へと拡張する。特に、種々の疾病マーカーの検出、遺伝子デリバリーおよびドラッグデリバリーへの応用を目指す。