独立行政法人 産業技術総合研究所【理事長 野間口 有】浅島 誠フェローと器官発生工学研究ラボ【研究ラボ長 浅島 誠】桑原知子研究員らは、米国 ソーク研究所 Fred H. Gage 教授らと共同で、「成体の神経新生」が起きる仕組みを解明し、中心となる遺伝子とその活性化の道筋をつきとめました。さらに、タンパク質の遺伝情報を保持している翻訳領域の遺伝子だけではなく、ゲノムの大半を占める非翻訳領域にも重要な役割がある可能性を明らかにしました。
成人では脳内の神経細胞は再生しないと考えられていましたが、成人脳内の海馬という部分には神経幹細胞が存在し、神経幹細胞から制御されながら新しい神経細胞がたえず作られています。成体においてそれを制御するメカニズムはこれまで不明でしたが、今回マウスを用いた実験によりその制御メカニズムを解明しました。
なお、本研究成果は、2009年9月号のNature Neuroscience誌(Volume 12, No.9)に掲載されました。1,2
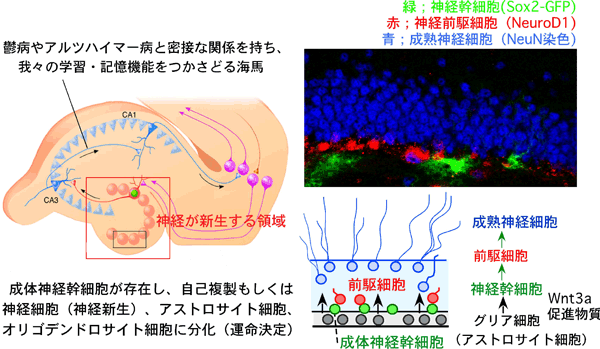
成体の脳内の海馬には神経幹細胞が存在し、それから新しい神経が作られます(図1)。成体の海馬で生じる神経新生現象は、記憶や学習機能、また鬱病やアルツハイマー等の神経疾患とも密接な関係があります。神経疾患治療への応用や、効果的な創薬・医療の標的の探索には、『成体』での神経幹細胞から新しい神経細胞への分化制御の仕組みを解明することが重要です。
 |
|
図1: 成体の脳内、海馬に存在する成体神経幹細胞。成体神経幹細胞から新しい神経細胞が生み出される(神経新生)。
|
産総研器官発生工学研究ラボでは、成体の幹細胞を解析し、再生医療・創薬開発に役立てる研究をしています。
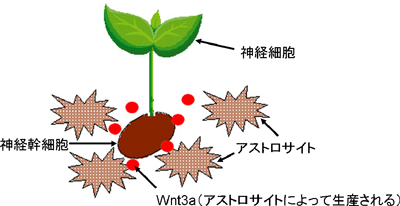
成体の神経幹細胞は、自分自身を複製する能力と、神経細胞、アストロサイト細胞、オリゴデンドロサイト細胞の3種類の細胞に分化できる「多能性」を持っています。神経細胞にとって、アストロサイト細胞やオリゴデンドロサイト細胞などのグリア細胞は、神経細胞を支える足場でもあります。足場となる良い土がないと植物が育たないように、土は「アストロサイト細胞」、種は「神経幹細胞」、枝葉を伸ばす植物は「神経細胞」に例えることができます(図2)。「土」が「種」に与える栄養が『Wnt3a』(ウィント3a)という名のWntシグナル系タンパク質であることは分かっていましたが、その先どうやって種から芽を出すか(神経新生)という詳しい仕組みが分かっていませんでした。そこで、成体の海馬の神経幹細胞で、『Wnt3a』因子の働きを特異的に絶つと、どうなるかについて、遺伝子改変マウスやラットの実験動物、神経幹細胞の培養系で解析しました。
 |
|
図2: 神経幹細胞、神経細胞、アストロサイト細胞の共存関係。アストロサイト細胞が栄養源となる因子(Wnt3a)を産出すると、それを受け取った成体神経幹細胞から新しい神経細胞が生み出される。
|
(1)Wntシグナル系タンパク質Wnt3aの役割解明
アストロサイト細胞で生産され、神経幹細胞から神経細胞への分化を促進するWntシグナル系タンパク質Wnt3aが作用すると、神経幹細胞のβカテニンが安定化されます。安定化されたβカテニンは核内に移行し、他の転写因子TCF、LEFと複合体を形成し、この複合体が神経幹細胞から神経細胞への分化を左右する制御配列を認識することを見いだしました。一方、神経幹細胞を分化させないようにするSox2という未分化維持作用をもつ転写因子があります。Sox2転写因子が認識する配列と、βカテニン・TCF・LEF複合体が認識するDNA配列を比べると、両者が共通に認識できる配列の有ることが分かりました。その配列を「Sox/LEFオーバーラップ配列」(スイッチエレメント)と定義づけました。この配列は分子認識スイッチの役割を持ち、Sox2による未分化維持のための「抑制」の指令か、Wnt3aからの神経新生のための「活性化」指令か、どちらか一方のみを、DNA下流の遺伝子に伝達します(転写開始)。
新しく発見した「Sox/LEFオーバーラップ配列」は、マウス、ラット、ヒトのNeuroDという遺伝子のプロモーター領域に共通して保存されていることをDNAデータベースにより確かめました。このNeuroD1タンパク質は神経幹細胞から神経細胞への分化を誘導する中心的な機能をもつ転写因子タンパク質です。
胎生期では、NeurogeninというWntとは別の遺伝子が直接NeuroD遺伝子を活性化することが分かっていましたが、成体では、Neurogenin遺伝子ではなく、Wnt3aによるWntシグナリング(タンパク質ネットワーク)系下流のβカテニンと転写因子TCF、LEFが共同してNeuroD1遺伝子を活性化することが分かりました。
胎生期の神経新生では、アストロサイト細胞よりも先に神経細胞のみが初期段階に発生します。つまりWnt3aを産出する『土』が無い状態でも、「芽を伸ばしなさい」という指令が、『種』に元から内在されており、成体期の神経新生とは異なる強いメカニズムが支配しているといえます。一方、成体期の神経新生は胎生期とは違って、『種(幹細胞)』はどの運命を辿るかが未定です。アストロサイト細胞からWnt3aというシグナルを受け取ると、その下流の転写因子が、NeuroD遺伝子を活性化して神経新生を起こします。NeuroD遺伝子のプロモーターは、『種(幹細胞)』の状態では、Sox2による「抑制(まだ、眠っていなさい)」という指令が働くため、未分化状態(幹細胞の自己複製)を保ちます。
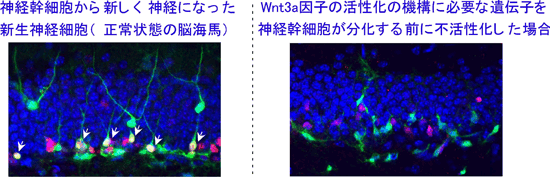
Wnt3aからのシグナルをシグナル系下流のβカテニン遺伝子から絶つと、どうなるかという、運命決定への影響を、ラットと遺伝子改変マウスの両方の成体の海馬で調べました。その結果、βカテニン遺伝子を成体の神経幹細胞で抑制すると、幹細胞は新しい神経を生み出すことがほとんどできなくなることがわかりました(90%以上の抑制:図3)。
 |
|
図3左:マウスの正常な海馬での神経新生。未分化状態の神経幹細胞から新しく産まれた細胞は、蛍光GFPタンパク質を発現するように設定している(緑;Sox2-CREGFPを発現している細胞)。新しく生まれた細胞は、神経分化に必要な遺伝子であるNeuroD1を発現している神経前駆細胞(赤;NeuroD1抗体で染色)になり、さらに成熟化した神経細胞に成長している様子を示している。NeuroD1を発現している細胞(赤;NeuroD1抗体陽性)と緑(Sox2CREGFPを発現している細胞)が重なっている細胞を白い矢印で示している(新生神経細胞)。青は細胞核のDAPI染色。
図3右:Wnt3a因子の作用するβカテニン遺伝子を発現できなくしたマウスの海馬の様子。未分化状態から生まれた細胞はあるが(緑;Sox2CREGFPを発現している細胞)、NeuroD1を発現している細胞(赤;NeuroD1抗体陽性)と緑(Sox2CREGFPを発現している細胞)がほとんど重ならない。新しい神経細胞が、ほとんど産み出されていない様子を現している。
|
一方、Wnt3aシグナルを阻害しても、神経幹細胞自体の自己複製やアストロサイト細胞などのグリア細胞への分化には影響を与えず、神経細胞への分化のみ影響を受けることが分かりました。この現象の主な原因は、Soxにより抑制されている成体神経幹細胞がNeuroDによる初期前駆細胞に変化する直前に、NeuroD遺伝子を発現できなくすることによって、アポトーシスにより死滅することをつきとめました。
(2)非翻訳領域の役割
Wnt3aシグナルからの活性化の道筋はNeuroD遺伝子だけではなく、ゲノムの大半を占める非翻訳領域にも伝わることを発見しました。タンパク質になるコーディング遺伝子は、ゲノム上に2%以下しかありません。哺乳動物の遺伝子の総数は大腸菌や酵母と比べて数倍ですが、反面、ゲノムのサイズは約200倍もの大きなものです。我々のゲノムの98%以上が非翻訳領域であり、進化の過程で哺乳類になって爆発的にゲノムに含まれる割合を増やしたものが「
レトロトランスポゾン」という動く遺伝子です。この「レトロトランスポゾン」が成体の脳の神経新生段階で発現されることが最近判明していましたがが、その活性化の仕組みは全く分かっていませんでした。
「レトロトランスポゾン(L1)」のDNA配列上に、「Sox/LEFオーバーラップ配列」が含まれており、また種間で保存されていることを見つけました。Wnt3aからのシグナルが活性化されると、NeuroD遺伝子だけではなく、ゲノムの大半を占める非翻訳領域にあるレトロトランスポゾンも活性化することが確かめられました(図4)。
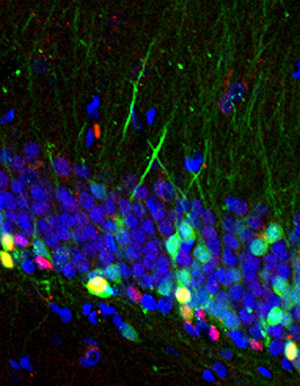 |
図4: 神経に分化し始めた神経前駆細胞(赤;NeuroD1抗体で染色した細胞)と、レトロトランスポゾンの活性化している神経細胞(緑;L1-GFP)。レトロトランスポゾンが活性化した細胞だけが、蛍光GFPタンパク質を発現するような レンチウイルス(L1-GFP)をラット脳海馬に注入した。青は細胞の核をあらわしている(DAPI染色)。 |
このことは、レトロトランスポゾン配列の近くにある遺伝子も、その影響を間接的に受けて発現量が上昇する可能性を示唆しています。つまり、ある1つのシグナルから、神経新生を誘導する機能を持つコーディング遺伝子NeuroD1が発現されるだけではなく、ゲノムの大半に渡って活性化される領域が増幅する仕組みです(図5)。脳の神経細胞で特異的にレトロトランスポゾン(L1)の発現が活性化されることが、げっ歯類とヒト3で確かめられています。レトロトランスポゾン(L1)は、RNAの逆転写反応を介して自分自身をゲノム上の別の場所に埋め込む『動く遺伝子(Jumping gene)』として知られており、我々一人一人が、脳内で多種の神経細胞(多様性)をつくり出す一因と考えられています。
そこで、バイオインフォマティクス解析で、マウス、ラット、ヒトのゲノム上でレトロトランスポゾン(L1)近傍にあり、L1上の「Sox/LEFオーバーラップ配列」によりWnt3aからのシグナルが間接的に伝達される遺伝子を探索しました。すると興味深いことに、これまでに神経新生のマーカーとなっていた遺伝子や、神経疾患に関連する遺伝子、細胞周期(セルサイクル)を調節する遺伝子、神経の突起やシナプス形成に関与する神経に特異的な遺伝子などが数多く明らかになりました。
(3)成体の神経幹細胞から神経新生の制御機構のまとめ(図5)
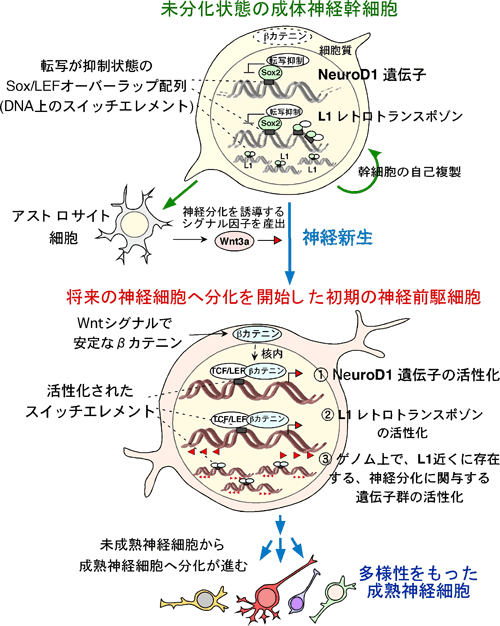 |
図5: 成体の神経幹細胞から神経新生の制御機構のまとめ
神経幹細胞や神経細胞の足場になっているアストロサイト細胞が、神経分化を誘導するWnt3a因子を産出する。すると、成体神経幹細胞は神経分化を開始する。Wnt3a因子は、個人の状態や環境によって、その活性が変化するシグナルでもある。
-
成体神経幹細胞がWnt3aのシグナルを受け取ると、コーディング遺伝子であるNeuroD1遺伝子の転写が活性化される。
-
NeuroD1遺伝子はタンパク質に翻訳されると、神経細胞への分化を誘導する中心的な機能を持つ転写因子として働く。Wnt3aのシグナルを同時に受け取るのが、レトロトランスポゾン遺伝子(L1)。
-
レトロトランスポゾン遺伝子(L1)遺伝子はゲノム上を動きまわり、L1近くの神経分化に関係する遺伝子群の発現を活性化する。これにより脳の個々の神経細胞の多様性を作る一因を担う事が判明している3。また、非翻訳領域に、L1の断片化した配列が非常に多く含まれている。そのため、Wnt3aのシグナルはスイッチエレメントを持つL1配列近傍の遺伝子群にも伝わる。これらの遺伝子群には、神経疾患に関連する遺伝子や、神経突起やシナプスを形成する遺伝子、細胞分裂や細胞周期を調整する遺伝子などの存在することがバイオインフォマティクスの解析から明らかになった。
|
成体の神経新生は、個人の状態によっても左右される現象です。活発な運動(我々が行うランニングなどに相当する運動)を促したマウスや良い環境で育てられたマウスの脳ではWnt3aの発現が上昇することも分かっており、Wnt3aは個人の状態を伝達する因子とも考えられます。成体の脳では豊富な種類の神経細胞が生み出されるわけですが、今回の研究により、より個人の状態に密接にリンクしたシグナルからゲノムの非翻訳領域を介して、豊富な種類の神経細胞を新しく産み出す仕組みの糸口が見えてきたといえます。今後、バイオインフォマティクス解析からWnt3aの影響を受けることが明らかになった遺伝子群を標的とした再生医療や創薬開発への応用研究に取り組んでいきます。
(1) Kuwabara, T., Hsieh, J., Muotri, A., Yeo, G., Warashina, M., Lie, D.C., Moore, L., Nakashima, K., Asashima, M. & Gage, F.H. (2009) Wnt-mediated activation of NeuroD1 and retro-elements during adult neurogenesis, Nature Neuroscience 12, 1097-1105.
(2) Vanderhaeghen, P. (2009) Wnts blow on NeuroD1 to promote adult neuron production and diversity, Nature Neuroscience 12, 1079-1081.
(3) Coufal NG, Garcia-Perez JL, Peng GE, Yeo GW, Mu Y, Lovci MT, Morell M, O'Shea KS, Moran JV & Gage FH. (2009) L1 retrotransposition in human neural progenitor cells. Nature 460, 1127-1131.