独立行政法人 産業技術総合研究所【理事長 吉川 弘之】(以下「産総研」という)、健康工学研究センター【研究センター長 国分 友邦】、生体ナノ計測チーム 石川 満 研究チーム長、伊藤 民武 研究員は、表面増強ラマン散乱(SERS: Surface Enhanced Raman Scattering)分光法を用いて、生きている細胞の表面にあるタンパク質を、数秒程度で迅速にその場(in situ)測定する方法を開発した。
ラマン散乱分光法は分子の識別能力に優れているものの、感度自体は低い測定手法である。高感度化の手法のひとつがSERS分光法であり、金、銀などの表面で分子のラマン散乱光の強度が非常に大きくなる現象を利用するものである。今回、酵母細胞表面に銀のナノ粒子を吸着させてSERS現象を実現し、高感度でラマン散乱の測定することに成功した。細胞に銀ナノ粒子を吸着させるとSERS現象による輝点が多数、細胞表面に観測されたが、解析の結果から、単一のタンパク質分子からのSERS光の散乱である可能性が高いことが分かった。また、細胞にとってマイルドな強度の励起レーザー光を用いたが、測定時間1秒でもスペクトルの測定が可能であった。このようなマイルドな条件で、生きたまま細胞表面のタンパク質分子ひとつを迅速に計測できたのはこれが初めてである。
なお、本成果は、アメリカ物理学協会の専門誌Applied Physics Lettersに3月10日掲載された。
細胞の表面にあるタンパク質分子は細胞内外の物質輸送、細胞外環境の認識など生体組織の活動に必要な機能を担っている。これらのタンパク質分子の測定は生命活動の本質の解明や創薬、健康診断法開発などの産業応用からも重要である。しかし、細胞表面に存在するタンパク質を、生きたままで、その場(in situ)で迅速かつ高感度に検出・同定するための有効な測定手段がこれまでなかった。従来の測定手段として、抗原・抗体反応と組み合わせた蛍光標識法が知られているが、この方法には、蛍光の消光や退色という大きな問題点がある。これらの問題点を解決できる可能性のひとつとして、消光現象がないラマン散乱の応用がある。ラマン散乱分光法は蛍光標識法に比べて分子の識別能力が高いという利点もある。しかし、ラマン散乱分光法の感度は低く細胞表面の測定への適用は非常に困難であった。最近、高感度化のために、ラマン散乱光の強度が最大で1014倍程度増強するSERSを利用した分光法が提案されている。SERS分光を用いると、生体組織や細菌などのタンパク質分子ひとつの識別が可能になると期待され、世界中で研究開発が展開されている。
産総研 健康工学研究センターでは、プラズモン共鳴によるラマン励起光の増強、ラマン散乱光の増強という2段階の電磁場増強モデルに基づいたSERS原理を検証してきた。その結果、SERS本来の増強度を効率的に発現させるために必要な実験条件を明らかしてきた。また、最大で1014倍のSERS強度増強が2つの銀ナノ粒子の接合部で実現可能であることを検証してきた。
生きた酵母細胞の表面に銀ナノ粒子(平均直径40nm)を吸着させてレーザー光を照射したところ、銀ナノ粒子付近に輝点が観測された(図1)。銀ナノ粒子によってSERS現象が起こっていると考えられる。顕微鏡を用いて一つ一つの銀ナノ粒子付近からのSERS光のスペクトル測定を行なった(図2)。励起光であるレーザー(波長532nm)の照射強度を15 W/cm2としたところ、測定時間1秒でスペクトルが測定できた(図3)。従来の細胞のラマン散乱分光の際のレーザー光照射条件(~105 W/cm2、~300 s)に比べて、はるかに微弱かつ短時間の照射であり、細胞にとってマイルドな条件である。生きている細胞を測定する際に、細胞への影響を極力抑えることは非常に重要なことである。
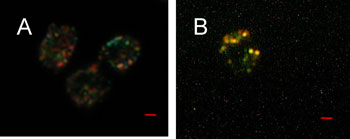 |
図1
(A)銀ナノ粒子が吸着した酵母細胞のプラズモン共鳴光散乱画像。酵母細胞表面に銀粒子による緑や赤のスポットが確認できる。
(B)銀ナノ粒子が吸着した酵母細胞のSERS光画像。酵母細胞表面に吸着した銀ナノ粒子から選択的にSERSが出ている。スケールバーは1µm。
|
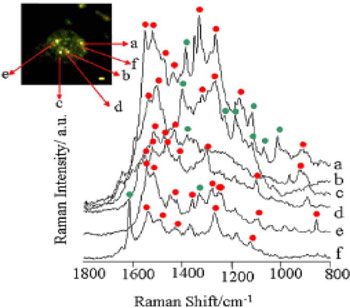 |
図2
銀ナノ粒子を吸着させた酵母分子ひとつからのSERSスペクトルと酵母細胞のSERS光画像。スケールバーは 1µm。
スペクトルaからfは、画像中のaからfで示した輝点のSERSスペクトル。
赤点はタンパク質分子による散乱と帰属できたラマンバンド。緑点は帰属できなかったラマンバンド。
|
 |
図3
実験装置の概観。顕微鏡サンプル面に設置された酵母細胞を白色光、レーザー光で照射し、その散乱光を分光測定できる。
|
測定されたSERS光は点滅現象を示した。この点滅現象は銀ナノ粒子に吸着した分子の揺らぎによって生じるもので、多数の分子からのSERS光ならば観測されない現象である。つまり、単一のタンパク質分子のSERS光を測定している可能性が高い。また、SERS現象を示している酵母細胞の表面を原子間力顕微鏡を用いて観測したところ、吸着前には一粒子ごとに孤立していた銀ナノ粒子が細胞表面に吸着すると、多くは2個がくっつきあっている構造(2量体構造)になっていることがわかった(図4)。2量体構造をとっている場合、2個の粒子の接合部ではSERS活性が著しく高い、すなわちラマン散乱光の強度が非常に増強されることが知られている。また、接合部の間隔はナノメートル程度であるため、接合部に入り込めるタンパク質分子は1個程度となる。ほとんどの銀ナノ粒子が2量体構造となっていることから、今回測定したSERSスペクトルは銀ナノ粒子2量体の接合部に吸着した単一のタンパク質分子のスペクトルである可能性が高い。
酵母細胞の表面には、タンパク質分子の他に、マンナン、グルカン、キチン等の多糖類分子が存在しているが、今回測定したSERSスペクトルを解析したところ、窒素原子などを含む官能基に起因する散乱が多く確認できた。これらの官能基はタンパク質に特有のもので、多糖類には含まれないものである。すなわち、今回のSERSスペクトルは多糖類分子からの散乱によるものではなく、細胞表面にあるタンパク質分子のスペクトルであり、目的とする分子の測定ができたと考えられる。タンパク質分子に含まれる窒素原子やイオウ原子は、銀ナノ粒子との親和性が高いことから、タンパク質分子だけが銀ナノ粒子に吸着してSERS現象を示したものと考えられる。
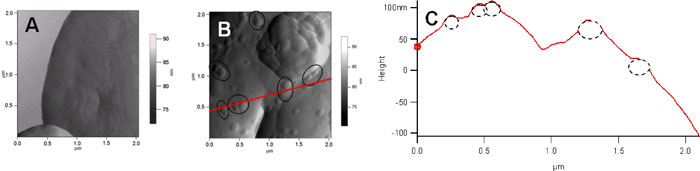 |
図4
(A)銀ナノ粒子が吸着していない1個の酵母細胞表面のAFM像。
(B)銀ナノ粒子が吸着した1個の酵母細胞表面のAFM像。2量体に見える粒子を黒色のサークルで囲ってる。なお、(A)とは異なる細胞の視野である。
(C)(B)で赤い線で示した場所の断面。使用した銀ナノ粒子のサイズ(平均直径40 nm)から期待される高さよりも突起の高さが低いので、銀ナノ粒子は細胞表面に一部埋もれていると推定される。左から2番目の粒子では、断面からも2量体構造が明瞭に観測されている。 |
銀には抗菌活性があるため、銀ナノ粒子は細胞に対して毒性を示す可能性がある。今回開発したSERS分光法による細胞表面タンパク質のその場測定技術の汎用性を高めるため、金ナノ粒子を用いたSERS分光法の開発を行なう。さらに、金ナノ粒子表面の修飾などを試み、SERS分光法の高度化を図る。